题目内容
某固体A在一定条件下加热分解,产物全是气体,A的分解反应为:2A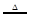 B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为
B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为
| A.2d | B.10d | C.5d | D.0.8d |
C
解析试题分析:根据阿伏伽德罗定律的推论:气体密度之比等于气体的摩尔质量之比。可知混合气体的平均摩尔质量为2d ,5mol混合气体总质量为10d,在根据质量守恒定律可得2molA的质量为10 d,所以A的平均摩尔质量为5d。
考点:考查阿伏伽德罗定律、质量守恒定律、物质的量的相关计算。

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C.10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D.标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.0.2 NA个氢分子的体积为4.48 L |
| B.常温常压下,5.85gNaCl中含有0.1NA个分子 |
| C.200mL 1 mol·L-1的Fe2(SO4)3溶液中Fe3+数小于0.4NA |
| D.1 molCl2与足量NaOH溶液充分反应,转移的电子数为2NA |
20mL 1mol ·L_1NaOH与1mol ·L_1的硫酸反应,溶液呈中性,则硫酸的体积为 ( )
| A.5 mL | B.l0 mL |
| C.20 mL | D.40 mL |
下列叙述正确的是(NA为阿伏加德罗常数的值)
| A.1 mol Na2O·SiO2中含有NA个Na2O |
| B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移NA个电子 |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28 g |
| D.4.6 g Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于0.1NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.22.4 L O2中含有氧分子的个数为NA |
| B.24g Mg与足量氧气反应转移的电子数为2NA |
| C.28g N2中含有氮原子的个数为NA |
| D.1 mol·L-1MgCl2溶液中含有氯离子个数为2NA |
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
| A.(b-a)/V mol·L-1 | B.(2b-a)/V mol·L-1 |
| C.2(b-a)/V mol·L-1 | D.2(2b-a)/V mol·L-1 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )。
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1 mol Na2CO3晶体中含CO32—离子数小于1NA |
| C.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体 11.2 L |
| D.0.1 mol的CaO2中含阴离子数是0.2NA |