��Ŀ����
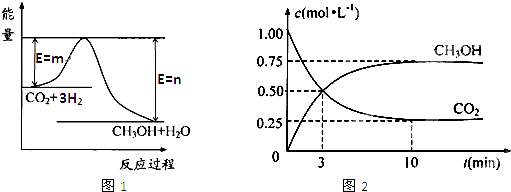
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����ͼ1��ʾ�÷�Ӧ���й����������ı仯��
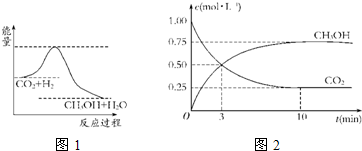
��1�����ڸ÷�Ӧ������˵���У���ȷ����
A����H��0����S��0�� B����H��0����S��0��
C����H��0����S��0�� D����H��0����S��0��
��2����ͼ����������ߵ����͵�֮��IJ�ֵ����
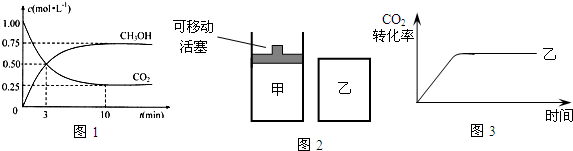
��3��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2
��3mol H2�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ���ӷ�Ӧ��ʼ��ƽ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��H2��
��4���£�N2H4����һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϣ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ������ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ�ǣ�

��1�����ڸ÷�Ӧ������˵���У���ȷ����
C
C
��A����H��0����S��0�� B����H��0����S��0��
C����H��0����S��0�� D����H��0����S��0��
��2����ͼ����������ߵ����͵�֮��IJ�ֵ����
�淴Ӧ�Ļ��
�淴Ӧ�Ļ��
��3��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2
��3mol H2�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ���ӷ�Ӧ��ʼ��ƽ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��H2��
0.225
0.225
mol?L-1?min-1����4���£�N2H4����һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϣ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ������ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ�ǣ�
N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol
N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol
����������1����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ���ɷ���ʽ��֪���÷�Ӧ����Ӧ����������ʵ�����С�ķ�Ӧ��������ӦΪ�ؼ����̣�
��2�����Ӵӳ�̬ת��Ϊ��������ѧ��Ӧ�Ļ�Ծ״̬����Ҫ��������Ϊ��ܣ�
��3����ͼ2��֪���״���Ũ�ȱ仯��Ϊ0.75mol/L������v=
����v��CH3OH��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��H2����
��4�������ºͷ�Ӧ�ȵĹ�ϵ�������ȼ���ȣ���д������Ӧ���Ȼ�ѧ����ʽ��
��2�����Ӵӳ�̬ת��Ϊ��������ѧ��Ӧ�Ļ�Ծ״̬����Ҫ��������Ϊ��ܣ�
��3����ͼ2��֪���״���Ũ�ȱ仯��Ϊ0.75mol/L������v=
| ��c |
| ��t |
��4�������ºͷ�Ӧ�ȵĹ�ϵ�������ȼ���ȣ���д������Ӧ���Ȼ�ѧ����ʽ��
����⣺��1����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ������H��0���ɷ���ʽ��֪���÷�Ӧ����Ӧ����������ʵ�����С�ķ�Ӧ��������ӦΪ�ؼ����̣�����S��0��ѡC��
��2����������ߵ����͵�֮��IJ�ֵ�����淴Ӧ�Ļ�ܣ��ʴ�Ϊ���淴Ӧ�Ļ�ܣ�
��3����ͼ2��֪��10min��ƽ��ʱ�״���Ũ�ȱ仯��Ϊ0.75mol/L������v��CH3OH��=
=0.075mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��H2��=3v��CH3OH��=3��0.075mol/��L?min��=0.225mol/��L?min�����ʴ�Ϊ��0.225��
��4��32.0g�µ����ʵ���Ϊ1mol��1molN2H4����������ȫȼ�����ɵ����ų�����624kJ���������Ȼ�ѧ��Ӧ����ʽΪ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol���ʴ�Ϊ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol��
��2����������ߵ����͵�֮��IJ�ֵ�����淴Ӧ�Ļ�ܣ��ʴ�Ϊ���淴Ӧ�Ļ�ܣ�
��3����ͼ2��֪��10min��ƽ��ʱ�״���Ũ�ȱ仯��Ϊ0.75mol/L������v��CH3OH��=
| 0.75mol/L |
| 10min |
��4��32.0g�µ����ʵ���Ϊ1mol��1molN2H4����������ȫȼ�����ɵ����ų�����624kJ���������Ȼ�ѧ��Ӧ����ʽΪ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol���ʴ�Ϊ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol��
���������⿼��ƽ��ͼ��ѧƽ���йؼ��㡢��Ӧ���ʡ���ѧƽ���Ӱ�����صȣ��ѶȲ���ע������֮�ȵ��ڻ�ѧ������֮�ȣ�

��ϰ��ϵ�д�
�����Ŀ
 ������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��
������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g�� CH3OH��g��+H2O��g����������ͼ��ʾ�÷�Ӧ���й�������������λΪkJ?mol-1���ı仯��
CH3OH��g��+H2O��g����������ͼ��ʾ�÷�Ӧ���й�������������λΪkJ?mol-1���ı仯��