题目内容
【题目】硫、氮、氯其化合物在生产生活中应用广泛。请回答:
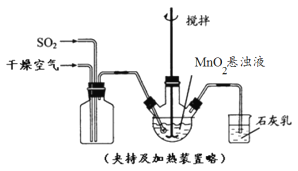
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式___________。
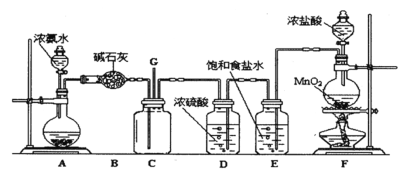
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是___________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________
【答案】褪色 变红 H2SO4 2 2CO+2NO![]() N2+2CO2 ClO-+Cl-+2H+=Cl2↑+H2O Cl2+2NaOH=NaClO+NaCl+H2O
N2+2CO2 ClO-+Cl-+2H+=Cl2↑+H2O Cl2+2NaOH=NaClO+NaCl+H2O
【解析】
(1)二氧化硫与品红化合生成无色物质不稳定,溶液褪色,加热已褪色的溶液,溶液又恢复为红色。所以将SO2通入品红溶液中,现象为品红溶液褪色,加热后溶液颜色变红。故答案为:褪色;变红;
(2)SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中SO2中+4价的硫失去电子被氧化,得到氧化产物H2SO4。故答案为:H2SO4;
(3)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,每生成1molCO2,转移4mol电子,若生成0.5 mol CO2,则转移电子的物质的量是2mol。故答案为:2;
CO2↑+2SO2↑+2H2O,每生成1molCO2,转移4mol电子,若生成0.5 mol CO2,则转移电子的物质的量是2mol。故答案为:2;
(4)在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体N2和CO2,反应的化学方程式2CO+2NO![]() N2+2CO2。故答案为:2CO+2NO
N2+2CO2。故答案为:2CO+2NO![]() N2+2CO2;
N2+2CO2;
(5)NaClO具有强氧化性,在酸性条件下能将Cl-氧化。“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是ClO-+Cl-+2H+=Cl2↑+H2O(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,氯气能与氢氧化钠反应生成次氯酸钠和氯化钠,反应的化学方程式:Cl2+2NaOH=NaClO+NaCl+H2O。故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;Cl2+2NaOH=NaClO+NaCl+H2O。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________。
(2)写出氨分子的结构式:__________________。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________。
(4)完成下表
K层为最外层时,最多能容纳的电子数 | _________ |
除K层外,其他各层为最外层时,最多能容纳的电子数 | _________ |
次外层最多能容纳的电子数 | _________ |
倒数第3层最多能容纳的电子数 | _________ |
第n层里最多能容纳的电子数 | _________ |
【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。