题目内容
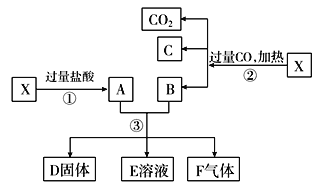
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。
(2)写出②、③中可能发生反应的离子方程式。
②_______________________、________________、_______________________、________________。
③_____________________、________________。
(3)步骤②中不用氨水沉淀Fe3+的原因:_____________。
【答案】SiO2 粉碎铝土矿、加热、增大盐酸的浓度(任填一种,其它合理答案亦可) H++OH-=H2O Al3++3OH-=Al(OH)3↓ Fe3++3OH-=Fe(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O OH-+CO2=HCO3- AlO2-+2H2O+CO2= Al(OH)3↓+HCO3- Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
【解析】
(1) ①铝土矿中含有Al2O3及少量SiO2、Fe2O3等杂质,加入盐酸时,Al2O3、Fe2O3与盐酸反应产生AlCl3、FeCl3进入溶液,酸性氧化物SiO2与盐酸不反应,所以加盐酸后的沉淀成分主要是SiO2;为了加快铝土矿在盐酸中的溶解,可采取的措施有将铝土矿粉碎,增大物质的接触面积;加热来提高反应温度或增大盐酸的浓度等方法;
(2)②向含有HCl、AlCl3、FeCl3的溶液中加入足量NaOH溶液,首先发生反应:H++OH-=H2O;然后发生:Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,最后发生:Al(OH)3+OH-=AlO2-+2H2O;
③在滤液甲中含NaOH、NaAlO2,向其中通入过量CO2气体,可能发生反应为OH-+CO2=HCO3-;AlO2-+2H2O+CO2= Al(OH)3↓+HCO3-;
(3)步骤②中不用氨水沉淀Fe3+是因为加入碱时Al3+会形成Al(OH)3沉淀,Al(OH)3只能溶于强碱,不能溶于氨水,若用氨水就不能将Fe(OH)3和Al(OH)3分离开。