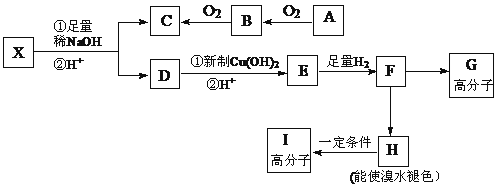
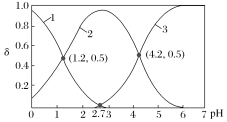
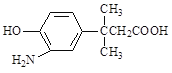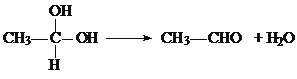题目内容
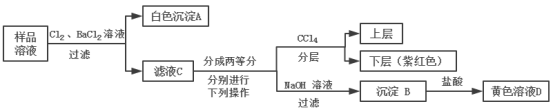
【题目】某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1mol/L,现进行如图实验(所加试剂均过量):
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、SO42-
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1L黄色溶液D,能恰好溶解铁1.4g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
【答案】A
【解析】
加氯气和氯化钡生成白色沉淀,故A为硫酸钡沉淀,所以原溶液可能含有![]() 或
或![]() ;由分层后的液体颜色呈橙红色,说明原溶液含Br-;加过量氢氧化钠得到沉淀B,再加盐酸溶解得到黄色溶液D,说明原溶液含Fe2+、无Cu2+,由于
;由分层后的液体颜色呈橙红色,说明原溶液含Br-;加过量氢氧化钠得到沉淀B,再加盐酸溶解得到黄色溶液D,说明原溶液含Fe2+、无Cu2+,由于![]() 与Fe2+不共存,所以原溶液不含
与Fe2+不共存,所以原溶液不含![]() ,一定含
,一定含![]() ,即原溶液中一定含Fe2+、Br-、
,即原溶液中一定含Fe2+、Br-、![]() ;各离子的物质的量浓度均为0.1molL-1,根据电荷关系可知一定含有Na+,一定无Mg2+,以此解答该题。
;各离子的物质的量浓度均为0.1molL-1,根据电荷关系可知一定含有Na+,一定无Mg2+,以此解答该题。
A.由上述分析可知,原溶液中一定含有Fe2+、Br、![]() 、Na+,一定不含有Cu2+、Mg2+、
、Na+,一定不含有Cu2+、Mg2+、![]() ,故A正确;
,故A正确;
B.由上述分析可知,原溶液中一定含有Fe2+,一定不含有Mg2+,所以沉淀B中肯定含有氢氧化铁,不含有氢氧化镁,故B错误;
C.1L黄色溶液D含有0.1molFe3+,根据2Fe3++Fe=3Fe2+,所以0.1molFe3+能溶解0.05molFe即2.8g,但D溶液中可能HCl过量,溶解Fe的量增加,故C错误;
D.因原溶液中含有![]() ,加入稀硝酸酸化的硝酸银会产生硫酸银干扰Cl-的检验,故D错误;
,加入稀硝酸酸化的硝酸银会产生硫酸银干扰Cl-的检验,故D错误;
故答案为:A。

【题目】右图为浓硫酸与铜片反应的装置。

请回答:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性 |
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染 |
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 |
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况) |