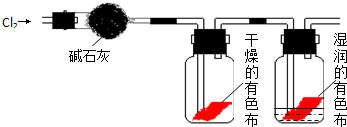
题目内容
6.维生素C又名抗坏血酸,易溶于水,能与碘反应.人体缺乏维生素C可能引发多种疾病.某同学了解到黄瓜等蔬菜、水果中含有丰富的维生素C后,对放置时间长短是否影响维生素C的含量产生了兴趣.他设计了如下实验方案:①把新鲜黄瓜和放置一周的黄瓜分别捣碎,用纱布将汁液挤入两个烧杯中.
②取两支盛有2mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下(淀粉溶液遇碘变蓝):
| 汁液 | 新鲜的黄瓜汁液 | 放置一周的黄瓜汁液 |
| 滴数 | 12 | 20 |
(1)你认为黄瓜中维生素C含量高的是新鲜的黄瓜;
(2)你从中得到的启示是要吃新鲜蔬菜和水果.
(3)黄瓜在食用时一般采取生吃或加食醋凉拌,不易采用高温煎炒.据此请你推测维生素C除了具有还原性外可能还具有的性质的是维生素C在酸性条件下稳定和维生素C在高温条件下易被氧化.
(4)根据上述实验的信息与提示,请设计实验证明维生素C具有还原性.要求写出实验所用的试剂、现象、和结论.
分析 (1)根据对照实验:使相同量的蓝色碘的淀粉溶液褪色,需要新鲜的黄瓜汁液量少分析;
(2)通过实验可以看出,新鲜的黄瓜汁液中维生素C含量高;
(3)根据题干信息:黄瓜在食用时一般采取生吃或加食醋凉拌,说明维生素C在酸性条件下稳定,不宜采用高温煎炒说明维生素C在高温条件下易被氧化;
(4)根据维生素C具有还原性,易被氧化,能与碘反应,可加入显色颜色的氧化剂,碘与淀粉显蓝色,据此设计实验证明维生素C具有还原性.
解答 解:(1)根据实验可以看出,使2mL蓝色碘的淀粉溶液褪色,需要新鲜的黄瓜汁液量12滴,需要放置一周的黄瓜汁液20滴,所以新鲜的黄瓜汁液中维生素花C的含量高,
故答案为:新鲜的黄瓜;
(2)由此可知维生素C的含量随着放置时间的增长会减少,新鲜的黄瓜汁液中维生素C含量高,要吃新鲜蔬菜和水果,
故答案为:要吃新鲜蔬菜和水果;
(3)黄瓜在食用时一般采取生吃或加食醋凉拌,说明维生素C在酸性条件下稳定,不宜采用高温煎炒说明维生素C在高温条件下易被氧化,据此推测维生素C除了具有还原性外可能还具有的性质的是:维生素C在酸性条件下稳定,维生素C在高温条件下易被氧化,
故答案为:维生素C在酸性条件下稳定;维生素C在高温条件下易被氧化;
(4)根据上述实验的信息可知:维生素C片(果汁等)富含维生素,维生素C具有还原性,易被氧化,能与碘反应,碘与淀粉显蓝色,所以可设计实验证明维生素C具有还原性方案为:试剂:维生素C片(果汁等)、碘水、淀粉;现象:蓝色的碘水-淀粉溶液褪色;结论:维生素C具有还原性,
故答案为:试剂为维生素C片(果汁等)、碘水、淀粉,现象为蓝色的碘水-淀粉溶液褪色,结论为维生素C具有还原性.
点评 本题为维生素C为载体考查化学实验方案的设计与评价,题目难度不大,注意根据题干提供的信息结合物质的性质设计实验方案,把握常见具有氧化性的物质及其颜色.

 同步奥数系列答案
同步奥数系列答案①500mL 0.1mol/L 的盐酸溶液; ②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液; ④1L 0.1mol/L 的酒精溶液.
| A. | ①②③④ | B. | ④①③② | C. | ②①③④ | D. | ①③②④ |
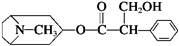
下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应,
其中错误的是( )
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
| 元素 | A | B | C | D | E | F |
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于非极性分子(填“极性”或“非极性”),化合物乙的电子式
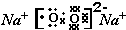 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.(3)元素B、D组成化合物丙,其晶体类型为离子晶体,化合物丙的溶液呈碱性(填“酸性”“碱性”或“中性”).
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高.
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65kJ 热量.则表示化合物丁的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.4KJ/mol.
②某实验小组依据丁燃烧的反应原理,设计如图所示的电池装置.
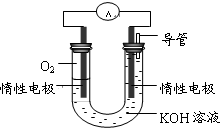
a.该电池正极的电极反应为O2+2H2O+4e-=4OH-.
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O.
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:BeO+2OH-=BeO22-+H2O.若E的氯化物熔沸点较低、易升华,则E的氯化物是共价化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择将其加热到熔融状态,做导电性实验,看其能否导电.
| A. | CH4分子的球棍模型: | B. | 羟基的电子式: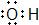 | ||
| C. | 醛基的结构简式:-CHO或HOC- | D. | 乙烯的实验式:CH2 |
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |