题目内容
【题目】能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)已达平衡状态的标志是( )
2SO3(g)已达平衡状态的标志是( )
A. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B. SO2和SO3的物质的量浓度相等
C. 反应容器内压强不随时间变化而变化
D. 单位时间内生成2 mol SO2时,也生成1 mol O2
【答案】C
【解析】容器中SO2、O2、SO3的物质的量之比为2∶1∶2无法证明反应达平衡,原因是有可能该反应是瞬间达到这个比例,然后就变化,选项A错误。SO2和SO3的物质的量浓度相等无法证明反应达平衡,原因是有可能该反应是瞬间浓度相等,然后就变化,选项B错误。反应容器内压强不变就是气体物质的量不变,该反应是气体减少的反应,所以压强不变能证明反应达平衡,选项C正确。单位时间内生成2 mol SO2时,也生成1 mol O2说的都是逆反应,没有提到正反应,所以选项D错误。

 阅读快车系列答案
阅读快车系列答案【题目】现有部分短周期元素的性质、应用或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层电子数是K层电子数的3倍 |
X | 一种同位素可测定文物年代 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X可测定文物年代的同位素符号是 .
(2)元素Z在周期表中的位置为 . Y单质的结构式为 .
(3)元素Y与氢元素形成一种离子YH4+ , 实验室检验溶液中含有这种离子方法是:(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 铜 | 氧化铜 | 稀硝酸 | 萃取 |
A. A B. B C. C D. D
【题目】氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是(填“A”或“B”);比较р1、р2的大小关系 . 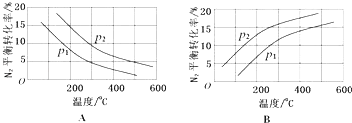
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)4NH3(g)+3O2(g),则其反应热△H= . 已知:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)2H2O(l)△H=﹣571.6kJmol﹣1 .