题目内容
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐 和纯碱的原料,也是一种常用的制冷剂.
(1)实验室制备氨气的化学反应方程式为 .
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)?2NH3(g)△H.
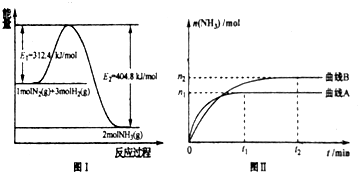
图I是合成氨反应的 能量与反应过程相关图(未使用催化剂);图Ⅱ是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
下列说法正确的是 .
A.△H=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图.且PA<PB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为
mol?L-1?min-1
(3)-定温度下,向一个容积为2L的密闭容器中通入2mol N2和7mol H2,达到平衡时 测得容器内的压强为起始时的
倍,则此温度下的平衡常数为 .在同一温度,同一容器中,将起始物质改为a mol N2、b mol H2、c mol NH3(a,b,c均不为零)欲使4平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为(用含a,b,c的表达式表示) .且欲使反应在起始时向逆反应方向进行,c的取值范围是 .
(4)已知H2(g)的燃烧热为2S5.8kJ/mol.试写出表示NH3(g)燃烧热的热化学反应方程式 以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为- 经测定,该电作过程中每 放出1mol N2实际提供460kJ的电能,则该燃料电池的实际效率为 (燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数).
(1)实验室制备氨气的化学反应方程式为
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)?2NH3(g)△H.
图I是合成氨反应的 能量与反应过程相关图(未使用催化剂);图Ⅱ是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.

下列说法正确的是
A.△H=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图.且PA<PB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为
| n1 |
| 4t1 |
(3)-定温度下,向一个容积为2L的密闭容器中通入2mol N2和7mol H2,达到平衡时 测得容器内的压强为起始时的
| 7 |
| 9 |
(4)已知H2(g)的燃烧热为2S5.8kJ/mol.试写出表示NH3(g)燃烧热的热化学反应方程式
考点:物质的量或浓度随时间的变化曲线,热化学方程式,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)实验室用加热NH4Cl和Ca(OH)2固体混和物的方法制取氨气并生成CaCl2和水.故可以写出化学方程式;
(2)N2(g)+3H2(g)═2NH3(g)△H=-92.4KJ/mol
A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol;
B.使用催化剂改变反应速率降低反应的活化能;
C.温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,结合氨气物质的量分析;
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,结合氨气物质的量分析;
F.该反应温度不变,反应的平衡常数随温度变化分析;
G.在曲线A条件下,反应从开始到平衡,计算氨气的反应速率,依据反应速率之比等于系数之比,得到消耗N2的平均速率=
;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数;起始量为amol N2、bmol H2、cmol NH3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”分析;
(4)依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式;根据原电池原理结合氧化还原反应的特征可以写出电极反应,根据电极方程式可以算出放出1mol N2理论提供的电能,进而计算效率.
(2)N2(g)+3H2(g)═2NH3(g)△H=-92.4KJ/mol
A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol;
B.使用催化剂改变反应速率降低反应的活化能;
C.温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,结合氨气物质的量分析;
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,结合氨气物质的量分析;
F.该反应温度不变,反应的平衡常数随温度变化分析;
G.在曲线A条件下,反应从开始到平衡,计算氨气的反应速率,依据反应速率之比等于系数之比,得到消耗N2的平均速率=
| △c |
| △t |
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数;起始量为amol N2、bmol H2、cmol NH3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”分析;
(4)依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式;根据原电池原理结合氧化还原反应的特征可以写出电极反应,根据电极方程式可以算出放出1mol N2理论提供的电能,进而计算效率.
解答:
解:(1)加热NH4Cl和Ca(OH)2固体混和物的方法制取氨气,反应为2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;
(2)A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol,故A正确;
B.使用催化剂改变反应速率降低反应的活化能,E1减小,故B错误;
C.为了提高转化率,反应是放热反应,温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低,故C错误;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,pA>pB ,压强越大氨气物质的量增大,故D错误
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,TA>TB,故E正确;
F.反应的平衡常数随温度变化,该反应温度不变,平衡常数不变,压强改变不影响平衡常数,图象中影响因素依据DE分析是温度改变,TA>TB,温度越高平衡逆向进行,平衡常数KA<KB,故F正确;
G.在曲线A条件下,反应从开始到平衡,V(NH3)=
=
mol/(L?min),反应速率之比等于系数之比,消耗N2的平均速率=
V(NH3)=
mol/(L?min),故G正确;
故答案为:AEFG;
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,则依据平衡三段式列式计算,设氮气消耗物质的量为x;
N2(g)+3H2(g)═2NH3(g),
起始量(mol/L) 2 7 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 2-x 7-3x 2x
达到平衡时测得容器内的压强为起始时的
倍,气体物质的量之比等于压强之比;2-x+7-3x+2x=
(2+7)
x=1
平衡常数K=
=0.25;
起始量为amol N2、bmol H2、cmol NH3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”;
N2(g)+3H2(g)═2NH3(g),
起始量(mol/L) a b c
转化量 a+
b+
0
则a+
=2 b+
=7;
因为平衡时氨气的浓度为2mol/L,要使反应完全正向进行,氨气的浓度为4mol/L,所以欲使反应在起始时向逆反应方向进行,c的取值范围是2<c<4
故答案为:0.25;a+
=2、b+
=7;2<c<4;
(4)H2(g)的燃烧热为285.8kJ/mol,表示NH3(g)燃烧热的热化学反应方程式为:NH3(g)+
O2(g)=
N2(g)+
H2O(l)△H=-382.5KJ/mol;
在氨燃料电池中,氨气失去电子,在负极反应,被氧化成氮气,氧气得到电子,在正极反应,由于在碱性介质中,根据电荷守恒可写出电极反应式为:2NH3-6e-+6OH-═N2+6H2O,根据氨的燃烧热的方程式可知,生成1mol氮气可以放出765KJ的热量,所以该燃料电池的实际效率为
×100%=60.1%,
故答案为:NH3(g)+
O2(g)=
N2(g)+
H2O(l)△H=-382.5KJ/mol;2NH3-6e-+6OH-═N2+6H2O; 60.1%.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol,故A正确;
B.使用催化剂改变反应速率降低反应的活化能,E1减小,故B错误;
C.为了提高转化率,反应是放热反应,温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低,故C错误;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,pA>pB ,压强越大氨气物质的量增大,故D错误
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,TA>TB,故E正确;
F.反应的平衡常数随温度变化,该反应温度不变,平衡常数不变,压强改变不影响平衡常数,图象中影响因素依据DE分析是温度改变,TA>TB,温度越高平衡逆向进行,平衡常数KA<KB,故F正确;
G.在曲线A条件下,反应从开始到平衡,V(NH3)=
| ||
| t1min |
| n1 |
| 2t1 |
| 1 |
| 2 |
| n1 |
| 4t1 |
故答案为:AEFG;
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,则依据平衡三段式列式计算,设氮气消耗物质的量为x;
N2(g)+3H2(g)═2NH3(g),
起始量(mol/L) 2 7 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 2-x 7-3x 2x
达到平衡时测得容器内的压强为起始时的
| 7 |
| 9 |
| 7 |
| 9 |
x=1
平衡常数K=
(
| ||||
|
起始量为amol N2、bmol H2、cmol NH3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”;
N2(g)+3H2(g)═2NH3(g),
起始量(mol/L) a b c
转化量 a+
| c |
| 2 |
| 3c |
| 2 |
则a+
| c |
| 2 |
| 3c |
| 2 |
因为平衡时氨气的浓度为2mol/L,要使反应完全正向进行,氨气的浓度为4mol/L,所以欲使反应在起始时向逆反应方向进行,c的取值范围是2<c<4
故答案为:0.25;a+
| c |
| 2 |
| 3c |
| 2 |
(4)H2(g)的燃烧热为285.8kJ/mol,表示NH3(g)燃烧热的热化学反应方程式为:NH3(g)+
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
在氨燃料电池中,氨气失去电子,在负极反应,被氧化成氮气,氧气得到电子,在正极反应,由于在碱性介质中,根据电荷守恒可写出电极反应式为:2NH3-6e-+6OH-═N2+6H2O,根据氨的燃烧热的方程式可知,生成1mol氮气可以放出765KJ的热量,所以该燃料电池的实际效率为
| 460 |
| 765 |
故答案为:NH3(g)+
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
点评:本题考查了热化学方程式书写方法,化学平衡影响因素分析判断,平衡常数计算应用,等效平衡状态的分析方法,原电池原理的应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列物质性质的比较,正确的是( )
| A、还原性:Na>Mg>Al |
| B、原子半径:P<S<Cl |
| C、溶解度:NaHCO3>Na2CO3 |
| D、热稳定性:NaHCO3>Na2CO3>H2CO3 |