题目内容
【题目】现有下列几种物质:①盐酸;②Na2O;③Na2O2;④Al(OH)3;⑤Na2CO3;⑥H2O;⑦CO2;⑧乙醇;⑨Cu;⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
【答案】②③④⑤⑥ ② Al(OH)3 + OH- = AlO2-+2H2O 1:1 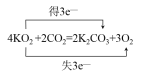 或
或![]()
【解析】
(1)①盐酸为混合物,不属于电解质;
②Na2O为离子化合物,属于电解质、碱性氧化物;
③Na2O2为离子化合物,属于电解质,过氧化物;
④Al(OH)3为离子化合物,属于电解质;
⑤Na2CO3为离子化合物,属于电解质;
⑥H2O属于电解质、氧化物;
⑦CO2不属于电解质,为氧化物;
⑧乙醇属于非电解质;
⑨Cu为单质,不属于电解质;
⑩NaOH溶液为混合物,不属于电解质;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水;
(3)过氧化钠中部分氧原子化合价升高为0价,部分降低为-2价,则过氧化钠既是氧化剂,又是还原剂,且物质的量之比为1:1;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍。
(1)①盐酸为混合物,不属于电解质;
②Na2O为离子化合物,属于电解质、碱性氧化物;
③Na2O2为离子化合物,属于电解质,过氧化物;
④Al(OH)3为离子化合物,属于电解质;
⑤Na2CO3为离子化合物,属于电解质;
⑥H2O属于电解质、氧化物;
⑦CO2不属于电解质,为氧化物;
⑧乙醇属于非电解质;
⑨Cu为单质,不属于电解质;
⑩NaOH溶液为混合物,不属于电解质;
综上所述,属于电解质的为②③④⑤⑥;碱性氧化物的为②;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3 + OH- = AlO2-+2H2O;
(3)过氧化钠中部分氧原子化合价升高为0价,部分降低为-2价,则过氧化钠既是氧化剂,又是还原剂,且物质的量之比为1:1;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍,则单线桥法为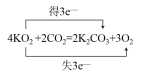 或
或![]() 。
。