题目内容
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,(1)写出A、B、C、D四种元素的名称。_____________________
(2)画出C-和D原子的结构示意图。_____________________
(3)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,有什么现象发生?写出有关反应的离子方程式。_______________________________________________________________
解析:根据0.5 mol A离子得到6.02×1023个(即1 mol)电子被还原为中性原子,可确定A离子为二价离子,故其氧化物可表示为AO。结合AO+2HCl![]() ACl2+H2O,可求得M(AO)=
ACl2+H2O,可求得M(AO)=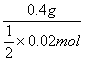 =
=
答案:(1)A.镁 B.铝 C.氯 D.碳
![]()
(3)先有白色沉淀产生,到沉淀达到最大量后,沉淀又逐渐溶解,最后形成无色溶液。有关
反应的离子方程式如下:Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
Al(OH)3+OH-![]()
![]() +2H2O。
+2H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



