题目内容
将标况下1.12L SO2 通入100mL含0.2mol/L RO4-的溶液中,恰好完全反应,SO2被氧化成SO42-,则反应后R的化合价为( )
| A、+6 | B、+4 | C、+2 | D、-2 |
考点:氧化还原反应的计算
专题:元素及其化合物
分析:SO2被氧化成SO42-,S元素的化合价升高,则R元素的化合价降低,结合电子守恒计算.
解答:
解:SO2被氧化成SO42-,S元素的化合价升高,则R元素的化合价降低,设反应后R元素的化合价为x,
由电子守恒可知,
×(6-4)=0.1L×0.2mol/L×(7-x),
解得x=+2,
故选C.
由电子守恒可知,
| 1.12L |
| 22.4L/mol |
解得x=+2,
故选C.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列微粒既具有氧化性又具有还原性的是( )
①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-.
①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-.
| A、①④⑤⑦ | B、③⑥⑦⑧ |
| C、④⑤⑥⑧ | D、①②③⑥ |
下列离子方程式书写正确的是( )
| A、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
B、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、将H2O2滴加到酸性KMnO4溶液中:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | ||||
| D、向含有FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
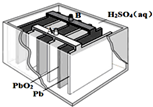 铅蓄电池是最常见的二次电池,其构造示意图如图.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如图.发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)
| 放电 |
| 充电 |
| A、放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
| B、铅蓄电池广泛用于汽车启动电源,可以边使用边充电,充电时,应将充电电源的正极与铅蓄电池的接线柱A相接 |
| C、实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D、铅蓄电池做电源电解AgNO3溶液,当有标况下11.2升O2产生时,消耗2mol H2SO4 |
下列有关说法错误的是( )
| A、医药中常用酒精消毒,是因为酒精能使细菌蛋白变性 |
| B、聚酯纤维、光导纤维都属于有机高分子材料 |
| C、对废旧电池回收处理是为了防止重金属污染水源和土壤 |
| D、绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |
有X,Y两种原子,对它们结构的下列描述中,能说明彼此化学性质一定相似的是( )
| A、电子排布式分别为:1s2和1s22s2 |
| B、X原子M层上只有两个电子,Y原子N层上也只有两个电子 |
| C、X原子的2p亚层上有二对成对电子,Y原子的3p亚层上也有二对成对电子 |
| D、X原子的2p亚层上只有一个未成对电子,Y原子的3p亚层上只有一个未成对电子 |
科学家及一些实业家的贡献对科学的发展起着积极地推动作用.下列对有关科学家及其发明创造的叙述,错误的是( )
| A、拉瓦锡证明了化学反应中的质量守恒,建立了燃烧的新理论 |
| B、舍勒发现了氯气,凯库勒提出了苯的结构式 |
| C、侯德榜发明了“候氏制碱”法,吴蕴初开创了中国的氯碱工业 |
| D、道尔顿、汤姆孙、卢瑟福和门捷列夫等科学家对原子结构模型的建立均作出了卓越的贡献 |
下列各组中的离子能在溶液中大量共存,当加入NaOH溶液时产生沉淀,而加入盐酸时则放出气体的一组离子是( )
| A、OH-、Ba2+、NO3-、K+ |
| B、Fe2+、Ca2+、Br-、SO32- |
| C、Cu2+、Na+、SO42-、Cl- |
| D、Na+、Ba2+、Cl-、HCO3- |
化学在生产和生活中有着重要的应用.下列说法正确的是( )
| A、硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
| B、“光化学烟雾”、“雾霾天气”、“温室效应”的形成都与氮氧化物无关 |
| C、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| D、明矾[KAl(SO4)2?12H2O]水解时产生具有吸附性的胶体粒子,可作净水剂 |