题目内容
下列顺序不正确的是
| A.热稳定性:HF > HCl > HBr > HI |
| B.微粒的半径:Cl-> Na+> Mg2+> Al3+ |
| C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 |
| D.分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液 |
C
试题分析:A、同主族元素从上到下非金属性减弱,气态氢化物的稳定性减弱,故稳定性HF>HCl>HBr>HI,正确;B、一般来说,电子层数越多,微粒半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,故微粒的半径:Cl-> Na+> Mg2+> Al3+,正确;C、HCl和 NaHCO3为强电解质,溶于水全部电离,电离程度均大于醋酸,错误;D、分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液,正确。

练习册系列答案
相关题目

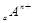 、
、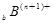 、
、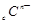 、
、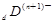 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是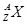 和
和 两种粒子,下列叙述正确的是
两种粒子,下列叙述正确的是  一定具有稀有气体元素原子的核外电子排布
一定具有稀有气体元素原子的核外电子排布