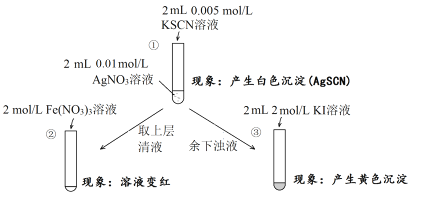
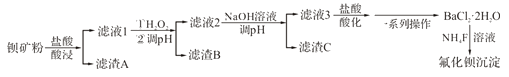
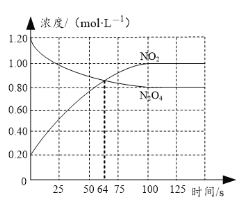
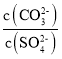题目内容
【题目】某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
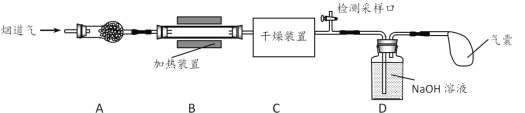
(1)装置A中放置无碱玻璃棉,其目的是除去___________。为保证检测的准确性,装置C中盛放的化学试剂可以是___________(填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为_______(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3-,发生反应的离子方程式是___________。
(3)溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2,实现氮元素的脱除,具体步骤如下:
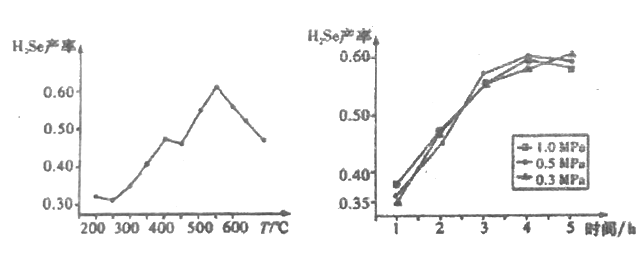
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是___________。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因________。
(4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl-,发生反应的离子方程式是___________。
【答案】粉尘 b a H2O2+NO2-=NO3-+H2O 金属铁和金属铝表面都有一层氧化膜 铝铁合金在溶液中形成原电池,加快化学反应速率 3HClO+2NO+H2O=2NO3-+3Cl-+5H+
【解析】
(1)烟道气中含有粉尘,装置A中放置无碱玻璃棉,可以除去粉尘;装置C用于除去少量的水蒸气,应该选择浓硫酸,NO2会与碱石灰反应,而五水硫酸铜不能起到干燥的作用;
(2)①根据化学方程式,可知NO2可以单独被NaOH吸收,而NO需与NO2按照1:1才能被NaOH吸收,现无尾气残留,说明NO无残留,因此NO2至少和NO一样多,则参加反应的NO2、NO物质的量比值为≥1,a符合题意;
②NO2-被氧化成NO3-,N的化合价从+3升高到+5,H2O2中的O的化合价应该降低,1molH2O2中的O的化合价从-1降低到-2,得到2mol电子,则H2O2和NO2-的系数比为1:1,再根据物料守恒或电荷守恒配平,离子方程式为H2O2+NO2-=H2O+NO3-;
(3)①根据题意,活泼金属能够将溶液中NO3-转化为N2,但是金属铝和金属铁在0-3h内,NO3-的脱除效率很低,几乎没有脱除,可认为金属与NO3-可能没有反应,可能是金属表面有氧化膜,阻碍了NO3-的脱除反应;
②铝铁合金中,铁和铝的活动性不同,可以构成原电池,加快化学反应速率;
③HClO中Cl的化合价从+1降低到-1,NO的化合价从+2升高到+5,根据化合价升降守恒的,则HClO和NO3-的系数为3:2,再根据物质守恒和电荷守恒配平,离子方程式为3HClO+2NO+H2O=2NO3-+3Cl-+5H+。

 阅读快车系列答案
阅读快车系列答案