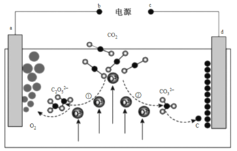
题目内容
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq) ΔH3 K3
HbO2(aq) ΔH3 K3
ΔH3=_____(用ΔH1、ΔH2表示),K3=_____(用K1、K2表示)。
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度![]() 的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
的关系如图1所示,pH=7.6时对应的曲线为_____(填“A”或“B”)。
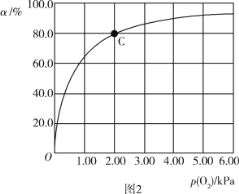
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g)![]() MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。

①已知Mb与氧气结合的反应的平衡常数的表达式K=![]() ,计算37 ℃时K=_____kPa-1。
,计算37 ℃时K=_____kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为______(结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH____(填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=______。37 ℃时,图2中C点时,![]() =____。
=____。
【答案】△H1+△H2 K1·K2 A 2.00 97.6% < 60 s-1 1.00
【解析】
(1)根据盖斯定律,将热化学方程式叠加,可得待求反应的热化学方程式,利用化学平衡常数的含义计算反应III的化学平衡常数;
(2)当pH>7.4时,与pH=7.4时相比,氢离子浓度减小,HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率;
HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率;
(3)①假设反应开始时Mb的浓度为1,根据物质的转化率,结合物质反应转化关系可计算该反应的化学平衡常数;
②根据K=![]() 可得a,带入p(O2)=20.0kPa可得a;
可得a,带入p(O2)=20.0kPa可得a;
③根据温度对化学平衡移动的影响分析反应热;
④根据化学反应达到平衡时v(正)=v(逆)及37℃时的平衡常数计算k2,根据37 ℃时反应平衡常数及图2中C点时结合度计算![]() 的值。
的值。
(1)已知:①Hb(aq)+H+(aq)![]() HbH+(aq) ΔH1 K1
HbH+(aq) ΔH1 K1
②HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq) ΔH2 K2
HbO2(aq)+H+(aq) ΔH2 K2
由于反应热与反应途径无关,所以①+②,整理可得:Hb(aq)+O2(g)![]() HbO2(aq) ΔH3=△H1+△H2,
HbO2(aq) ΔH3=△H1+△H2,
K1=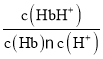 ,K2=
,K2=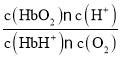 ,K3=
,K3=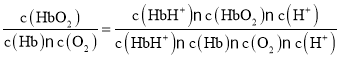 =
=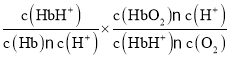 = K1·K2;
= K1·K2;
(2)当pH>7.4时,与pH=7.4时相比,氢离子浓度减小,HbO2(aq)+H+(aq)![]() HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率,所以根据图示可知曲线A符合要求;
HbH+(aq)+O2(g)的化学平衡逆向移动,增大了血红蛋白氧结合率,所以根据图示可知曲线A符合要求;
(3)①对于反应Mb(aq)+O2(g)![]() MbO2(aq),假设反应开始时Mb的浓度为1,转化率为a,则平衡时c(Mb)=(1-a),c(MbO2)=a,K=
MbO2(aq),假设反应开始时Mb的浓度为1,转化率为a,则平衡时c(Mb)=(1-a),c(MbO2)=a,K=![]() ,根据图示可知p(O2)=2.0kPa,a=80%,带入可得K=
,根据图示可知p(O2)=2.0kPa,a=80%,带入可得K=![]() =2;
=2;
②人正常呼吸时,体温约为37 ℃,此时的化学平衡常数K=2.0化学平衡常数K=![]() , p(O/span>2)=20.0 kPa,则人正常呼吸时2=
, p(O/span>2)=20.0 kPa,则人正常呼吸时2=![]() ,解得a=97.6%;
,解得a=97.6%;
③经测定,体温升高,Mb与氧气的结合度降低,结合平衡移动原理:升高温度,化学平衡向吸热反应方向移动,说明升高温度化学平衡逆向移动,逆反应为吸热反应,则该反应的正反应为放热反应,所以ΔH<0;
④当反应达到平衡时,v(正)= v(逆),由于v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),所以k1·c(Mb)·p(O2)= k2·c(MbO2),则![]() =K=2.0kPa,若k1=120 s-1·kPa-1,则k2=
=K=2.0kPa,若k1=120 s-1·kPa-1,则k2=![]() s-1=60 s-1;
s-1=60 s-1;
在图2中的C点,a=80%,处于平衡线上,则v(正)= v(逆),故![]() =1.00。
=1.00。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案