题目内容
元素A的单质能与H2化合生成HxA,在标准状况下8.5gHxA气体的体积是5.6L。含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,则:
(1)A 元素的相对原子质量 ,若A 的质子数等于中子数,则A是 元素(填名称)。
(2)A的最高价氧化物是 (填化学式)。这一氧化物在室温下呈 态,将其熔化需要克服 。
(3)HxA与CuCl2溶液反应的离子方程式 。
(4)A的单质在常温下是固体,在常温常压下0.25mol该单质完全燃烧放出QkJ的热量。写出该反应的热化学方程式: 。
(1)32 (2分) 硫(1分)
(2)SO3 固 分子间作用力 (每空1分)
(3)H2S+Cu=CuS↓+2H+ (2分)
(4)S(s)+O2(g)= SO2(g);△H=-4QkJ/mol (2分)
解析试题分析:(1)标准状况下5.6L气体的物质的量是0.25mol,所以HxA的相对分子质量是8.5/0.25=34,含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,5.1g的HxA的物质的量是0.15mol,200ml0.75mol/l的CuCl2的物质的量是0.15mol,二者的物质的量比是1:1,所以生成黑色沉淀的化学式为CuA,则A在HxA中的化合价是-2价,所以x=2,则A的相对分子质量是34-2=32,中子数等于质子数,所以质子数是16,为硫元素;
(2)S的最高价为+6,所以最高价氧化物的化学式是SO3,室温下呈固态,是分子晶体,熔化时克服分子间作用力;
(3)硫化氢与硫化铜的离子方程式为H2S+Cu=CuS↓+2H+
(4)S固体完全燃烧生成二氧化硫气体,0.25mol该单质完全燃烧放出QkJ的热量,则1mol完全燃烧放出4QkJ热量。热化学方程式为S(s)+O2(g)= SO2(g);△H=-4QkJ/mol
考点:考查元素的计算,最高价氧化物的化学式、状态、晶体类型的判断,离子方程式、热化学方程式的书写

用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA |
| B.1 mol乙烷分子含有8NA个共价键 |
| C.58.5 g的氯化钠固体中含有NA个氯化钠分子 |
| D.在0.1 mol过氧化钠固体中,阴离子总数等于0.1 NA |
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为 mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是 (填序号)。
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |

(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)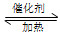 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的
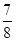 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
