题目内容
【题目】某晶体(结晶水合物)由五种短周期元素组成.常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个.将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示. 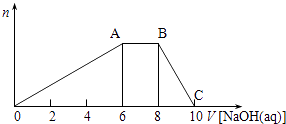
请回答下列问题:
(1)若该晶体的摩尔质量为906gmol﹣1 , 写出该晶体的化学式;
(2)B点溶液的pH7(填“<”、“>”或“=”),用化学用语表示其原因 .
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 .
(4)C点溶液中所含溶质的化学式为;此时溶液中各种离子浓度由大到小顺序为 .
【答案】
(1)(NH4)2SO4?Al2(SO4)3?24H2O
(2)>;NH3?H2O?NH4++OH﹣
(3)NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3?H2O+Al(OH)3↓+BaSO4↓
(4)Na2SO4、NaAlO2、NH3?H2O;c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+)
【解析】解:加入BaCl2溶液,说明溶液中有硫酸根离子,由图象随氢氧化钠的加入沉淀量先增加,后减少,而A→B沉淀量不变,说明铵根离子与氢氧根结合生成一水合氨,所以晶体是硫酸铝铵的结晶水合物,而O→A消耗氢氧化钠的体积是6,而A→B,消耗氢氧化钠是2,所以晶体组成中铵根离子与铝之比为:1;1,
(1.)硫酸铝铵的结晶水合物的化学式为(NH4)2SO4Al2 (SO4)3xH2O,得x= ![]() =24,所以晶体的化学式为:(NH4)2SO4Al2 (SO4)324H2O;故答案为:(NH4)2SO4Al2 (SO4)324H2O;
=24,所以晶体的化学式为:(NH4)2SO4Al2 (SO4)324H2O;故答案为:(NH4)2SO4Al2 (SO4)324H2O;
(2.)B点的溶质为硫酸钠和一水合氨,以氨水的电离为主,溶液呈碱性,氨水电离的方程式为:NH3H2ONH4++OH﹣ , 故答案为:>;NH3H2ONH4++OH﹣;
(3.)产生最多的沉淀,也就是硫酸根离子完全沉淀,所以离子方程式为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓,故答案为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓;
(4.)B→C,发生氢氧化铝溶解,所以C点的溶质为:Na2SO4、NaAlO2、NH3H2O,此时溶液呈碱性,一水合氨的电离大于偏铝酸盐的水解,而一水合氨电离产生的氢氧根离子对偏铝酸根离子的水解起抑制作用,所以离子浓度大小的顺序为:c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+),故答案为:c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+).
一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,说明溶液中有硫酸根离子,由图象随氢氧化钠的加入沉淀量先增加,后减少,而A→B沉淀量不变,说明铵根离子与氢氧根结合生成一水合氨,所以晶体是硫酸铝铵的结晶水合物,而O→A消耗氢氧化钠的体积是6,而A→B,消耗氢氧化钠是2,所以晶体组成中铵根离子与铝之比为:1;1,(1)硫酸铝铵的结晶水合物的化学式为(NH4)2SO4Al2 (SO4)3xH2O,求出x的值;(2)B点的溶质为硫酸钠和一水合氨,以氨水的电离为主,溶液呈碱性;(3)产生最多的沉淀,也就是硫酸根离子完全沉淀,所以离子方程式为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓;(4)B→C,发生氢氧化铝溶解,所以C点的溶质为:Na2SO4、NaAlO2、NH3H2O,此时溶液呈碱性,结合各离子的物质的量分析离子浓度的大小.

【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是(填元素符号)。
(2)元素⑧的原子结构示意图是;由①、④、⑥三种元素组成的化合物,其电子式是。
(3)元素②、⑧的气态氢化物的稳定性较强的是(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是(填化学式)。
(4)③、④、⑧三种元素的原子半径由大到小的顺序是(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是