题目内容
11.下列四种元素中,其单质氧化性最强的是( )| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 位于周期表中第三周期第ⅢA族的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
分析 原子含有未成对电子最多的第二周期元素是氮,位于周期表中第三周期ⅢA族的元素是铝,原子最外电子层排布为2s22p6的元素是氖,原子最外电子层排布为3s23P5的元素是氯,然后比较氧化性强弱.
解答 解:由原子含有未成对电子最多的第二周期元素是氮,位于周期表中第三周期ⅢA族的元素是铝,原子最外电子层排布为2s22p6的元素是氖,原子最外电子层排布为3s23P5的元素是氯,
A是氮元素,B是铝元素,C是氖元素,D是氯元素.氖为稀有气体元素,很稳定,铝是金属元素,单质具有还原性,氯和氮均为非金属,氯原子最外层为7个电子,更容易得电子,所以电子氧化性最强.
故选D.
点评 本题考查了核外电子排布规律的有关知识,难度不大,需要注意的是未成对电子根据轨道式来判断,比较方便,一目了然.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在同温同压下,下列各组热化学方程式中,Q1>Q2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
2.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质.其转化过程如下:
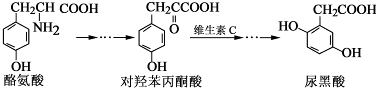
下列说法错误的是( )

下列说法错误的是( )
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
19.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
16.下表列出了①~⑨九种元素在周期表中的位置.请回答(用化学用语):
(1)在这些元素中,最活泼的金属元素是K;最活泼非金属元素是O;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.
(3)①、②、③三种元素的原子半径由大到小的顺序依次为K>Na>Mg.
(4)⑥元素的氢化物是H2O,该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的pH> 7.
(5)用电子式表示①和⑧元素形成化合物的过程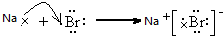 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式
 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)①、②、③三种元素的原子半径由大到小的顺序依次为K>Na>Mg.
(4)⑥元素的氢化物是H2O,该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的pH> 7.
(5)用电子式表示①和⑧元素形成化合物的过程
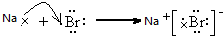 .
. 
 (用电子式表示).
(用电子式表示). .
.