题目内容
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
| A.图中A点溶液的pH=1 |
| B.生成沉淀的最大质量为2.33g |
| C.原混合溶液中盐酸物质的量浓度为0.1mol/L |
D.当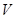 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO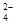 ═BaSO4↓ ═BaSO4↓ |
A
解析试题分析:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+2H2O,发生的离子方程式是2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,D错;20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4 + Ba(OH)2 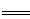 BaSO4↓ + H2O
BaSO4↓ + H2O
1 1 233g
x 0.02L×0.05mol·L-1 y
故x=0.02L×0.05mol·L-1=0.001mol,y=0.233g,
硫酸的物质的量浓度为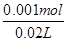 =0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol·L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度=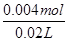 =0.2mol·L-1,C错;
=0.2mol·L-1,C错;
由图可知,A点硫酸完全反应,氢离子的浓度为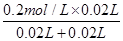 =0.1mol·L-1,则pH=-lg0.1=1,A对;
=0.1mol·L-1,则pH=-lg0.1=1,A对;
综上所述,所以选A。
考点:考查混合物的计算。

正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素; 、 、 、 、 、 、 互为同素异形体 互为同素异形体 |
| B.SiH4、PH3、HCl的稳定性逐渐增强 |
| C.氧化铁的化学式:FeO |
D.Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
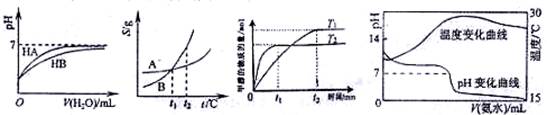
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
| A.只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B.t1~t2℃,MgSO4的溶解度随温度升高而减小 |
| C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大 |
| D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32—+O2+aOH-=Y+S4O62—+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32—是还原剂 |
| D.每有1 mol O2参加反应,转移电子的总物质的量为4 mol |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.24 g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
C.在碳酸钠溶液中,若c(C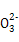 )="1" mol/L,则c(Na+)="2" mol/L )="1" mol/L,则c(Na+)="2" mol/L |
| D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA |
在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中K+的浓度约是(忽略溶液中少量的H+和OH-)( )。
| A.0.125 mol·L-1 | B.0.225 mol·L-1 |
| C.0.250 mol·L-1 | D.0.450 mol·L-1 |
下列变化中不属于化学变化的是( )。
| A.油脂的硬化 |
| B.S8受热后变为S2 |
| C.水泥制作水泥混凝土 |
D.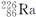 ―→ ―→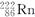 +He +He |
用 NA表示阿伏加德罗常数的值。下列说法正确的是( )
| A.1 mol Na2O2晶体中共含有4NA个离子 |
| B.0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1 NA个胶粒 |
| C.常温常压下,16 g O2和O3的混合气体中含有NA个氧原子 |
| D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |