题目内容
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式
【答案】
(1)Na;1s22s22p4; ![]()
(2)NaOH
(3)S2﹣; Al3+; Al(OH)3+3H+=Al3++3H2O
(4)H2O的稳定性大于H2S
(5)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3KJ?mol﹣1
【解析】解:(1)由元素在周期表中位置,可知①为O、②为Na、③为Mg、④为Al、⑤为S、⑥为Cl,电子层越多原子半径越大,所以第三周期的元素半径大于第二周期的元素,
同周期自左而右原子半径减小,表中元素,原子半径最大的是Na,①为O为8号元素,原子核外有8个电子,核外电子排布式为1s22s22p4,③和⑥两元素形成化合物为氯化镁,氯化镁是离子化合物,由镁离子与氯离子构成,电子式为 ![]() ,
,
所以答案是:Na;1s22s22p4; ![]() ;(2)②为Na、③为Mg、④为Al,三者位于同一周期,金属性Na>Mg>Al,则最高价氧化物对应水合物的碱性最强的为NaOH,
;(2)②为Na、③为Mg、④为Al,三者位于同一周期,金属性Na>Mg>Al,则最高价氧化物对应水合物的碱性最强的为NaOH,
所以答案是:NaOH; (3)S2﹣核外有三层电子,结构示意图为  ,Al3+核外有两层电子,结构示意图为:
,Al3+核外有两层电子,结构示意图为: 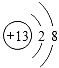 .离子电子层数越多,离子半径越大,则离子半径S2﹣>Al3+,元素④最高价氧化物对应的水化物为氢氧化铝,与硝酸生成硝酸铝和水,硝酸、硝酸铝拆成离子,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
.离子电子层数越多,离子半径越大,则离子半径S2﹣>Al3+,元素④最高价氧化物对应的水化物为氢氧化铝,与硝酸生成硝酸铝和水,硝酸、硝酸铝拆成离子,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
所以答案是:S2﹣;Al3+;Al(OH)3+3H+=Al3++3H2O;(4)元素的非金属性越强,对应氢化物的稳定性越强,H2O的稳定性大于H2S,则O的非金属性比S的强,
所以答案是:H2O的稳定性大于H2S;(5)8g甲烷n(CH4)= ![]() =0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890.3KJ的能量,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3KJmol﹣1,
=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890.3KJ的能量,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3KJmol﹣1,
所以答案是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3KJmol﹣1.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案