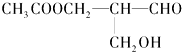题目内容
【题目】高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
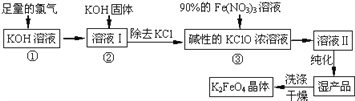
(1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。
(2)在溶液I中加入KOH 固体的目的是_____________________。(填编号)
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH 固体溶解时会放出较多的热量,有利于反应进行
C.为下一步反应提供碱性的环境
D.使KClO3 转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。
(4)如何判断K2FeO4 晶体已经洗涤干净___________________。
【答案】 2KOH+Cl2==KClO+KCl+H2O AC 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 用试管取少量最后一次洗液,加入硝酸银溶液,无白色沉淀,则已被洗净。
【解析】氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液,溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;则
(1)根据以上分析可知反应①的化学方程式为2KOH+Cl2==KClO+KCl+H2O。(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KclO。A、与过量的Cl2继续反应,生成更多的KClO,A正确;B、由信息②可知温度较高KOH与Cl2反应生成的是KClO3,不利用KClO生成、浪费原料,B错误;C、由工艺流程及③可知,利用硝酸铁与KClO制备K2FeO4,C正确;D、由信息可知,该条件下KClO3不能转化为KClO,D错误,答案选AC。
(3)由工艺流程及③可知,从“溶液II”中分离出K2FeO4后,会有副产品KNO3、KC生成,所以根据原子守恒、电荷守恒以及单质得失守恒可知反应③中发生的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;(4)产品表面有吸附的氯离子,判断K2FeO4晶体是否已经洗涤干净,设计实验检验洗涤液中是否含有氯离子即,步骤为:用试管取少量最后一次洗液,加入硝酸银溶液,无白色沉淀,则已被洗净。

【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
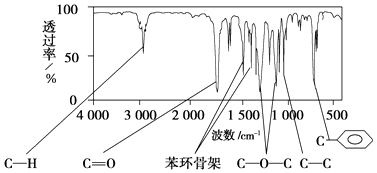
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式