题目内容
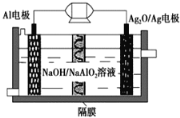
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( )![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
【答案】C
【解析】A、根据反应条件可知当温度不同时反应进行的主要方向不同,TaI4的量改变,A不符合题意;
B、因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,在一定条件下达到平衡后不再变化,B不符合题意;
C、在提纯过程中,I2的作用是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区以达到提纯的目的,C符合题意;
D、根据平衡常数表达式可知,平衡常数用平衡时生成物的浓度幂次方乘积除以反应物平衡浓度的幂次方乘积,所以平衡常数K与Tal4和S2的浓度乘积成正比,D不符合题意;
所以答案是:C.
【考点精析】解答此题的关键在于理解化学平衡常数的含义的相关知识,掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态.

练习册系列答案
相关题目