��Ŀ����
����Ŀ��H��N��Na��Al��Ti��Ԫ������Դ�����ϵ�����Ӧ�ù㷺���ش��������⣺
��һ���⻯����( NaAlH4)��һ���������ʴ�����ϣ���������Ti��NaAlH4��150��ʱ���⣬��170�桢15.2 MPa���������ظ����⡣NaAlH4����AlCl3��NaH���ʵ������ºϳɡ�NaAlH4��Ʒ���ṹ����ͼ��ʾ��Ϊ�����塣

(1)��̬Tiԭ�ӵļ۵����Ų�ʽΪ ___��L�ܲ��е����Ƶ���״��___ �֡�
(2)AlCl3��178��ʱ����������____���壬����������Է�������ԼΪ267���������ӵĽṹʽΪ____��������λ����������Alԭ�ӵ��ӻ���ʽΪ_______��
(3)д����AIH4-�ռ乹����ͬ��-�ַ��Ӻ�һ������_________���ѧʽ����
(4)NaAlH4�����У���AlH4�����ҵȾ��Na+��_______����NaAlH4������ܶ�Ϊ _____g/cm3(�ú�n�Ĵ���ʽ��ʾ)��
�������������ƺ��������( HN3)��һ�����������ǵ������������ȫ���ҵȡ�
(5)д����N3-��Ϊ�ȵ������һ�ַ���_____�����ʽ����
(6)������ᣨHN3)������(N2H4)��HNO2�����Ƶã�ͬʱ����ˮ�����������������______�����ţ�
A.��������HN3�Ļ�ѧ����ʽΪ��N2H4+HNO2=HN3+2H2O
B.NaN3�ľ����ܴ���KN3�ľ�����
C.�������(HN3)��ˮ���γɷ��Ӽ����
D.HN3��N2H4�����ɼ��Լ��ͷǼ��Լ����ɵķǼ��Է��ӡ�
E.HN3�������ĸ�ԭ�ӿ�����һ��ֱ����
���𰸡� ![]() 2 ����
2 ���� 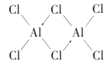 sp3 NH4+��CH4(��SO42-��PO43-��CCl4������������) 8
sp3 NH4+��CH4(��SO42-��PO43-��CCl4������������) 8 ![]() CO2��N2O DE
CO2��N2O DE
����������(1) Tiԭ�ӵĺ˵����Ϊ22��1s22s22p63s22p63d24s2����̬Tiԭ�ӵļ۵����Ų�ʽΪ3d24s2����̬Tiԭ�ӵļ۵����Ų�ʽΪ![]() ��L�ܲ���s ��p���������L�ܲ��е����Ƶ���״��2�֣���ȷ�𰸣�
��L�ܲ���s ��p���������L�ܲ��е����Ƶ���״��2�֣���ȷ�𰸣�![]() ��2��
��2��
��2��AlCl3��178��ʱ�������е��С�����ڷ��Ӿ��壻����������Է�������ԼΪ267���Ȼ�������ԭ����������ֻ��3������,�γ�3�����ۼ�,ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ�,������һ�����õ��Ӷ�����ԭ���ṩ�γɵ���λ��,��ͼ ��ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ�,����ԭ��Al�ļ۲���Ӷ���4,�ӻ�����Ϊ
��ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ�,����ԭ��Al�ļ۲���Ӷ���4,�ӻ�����Ϊ![]() ����ȷ�𰸣����ӣ�
����ȷ�𰸣����ӣ�  ��sp3 ��
��sp3 ��
(3) AlH4-��Al�Ĺ���ӻ���ĿΪ4+��3+11��4��/2=4��AlH4-��ȡsp3�ӻ���Ϊ�������幹�ͣ���AIH4-�ռ乹����ͬ��-�ַ��Ӻ�һ������NH4+��CH4(��SO42-��PO43-��CCl4�ȣ���ȷ���� NH4+��CH4(��SO42-��PO43-��CCl4�ȡ�
��4��NaAlH4�����У���Na+�����ҵȾ��AlH4-��8�����ֱ�λ�ھ���Na�����������ֱ������ƽ���ڣ�ÿ��ƽ������4����NaAlH4������ܶȣ�������AlH4-![]() ��Na��Ϊ
��Na��Ϊ![]() ��
��![]()
![]() ����
����![]() =
=![]() ����ȷ����8 ��
����ȷ����8 ��![]() ��
��
(5)�ȵ�����ָ����ԭ����Ŀ��ȣ�����������ȣ������N3-��Ϊ�ȵ������һ�ַ���CO2��N2O����ȷ�𰸣�CO2��N2O��
(6)N2H4��HNO2����HN3����ѧ����ʽΪ��N2H4+HNO2=HN3+2H2O��A��ȷ�����ڼ����Ӱ뾶���������Ӱ뾶�����K+��N3-֮���������С��Na+��N3-֮���������������NaN3�ľ����ܴ���KN3�ľ����ܣ�B��ȷ�������������(HN3)�Ľṹ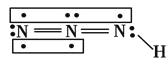 ��֪�����ڹµ��Ӷԣ��ܹ���ˮ�γ������C��ȷ��HN3�д��ڵ��⼫�Լ���û�зǼ��Լ���D������
��֪�����ڹµ��Ӷԣ��ܹ���ˮ�γ������C��ȷ��HN3�д��ڵ��⼫�Լ���û�зǼ��Լ���D������ ��֪��HN3�������ĸ�ԭ�Ӳ�������һ��ֱ���ϣ�E������ȷѡ��DE��
��֪��HN3�������ĸ�ԭ�Ӳ�������һ��ֱ���ϣ�E������ȷѡ��DE��

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д�����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | �����ѧ����ʽ | ���� |
A | ȡ1mL20%��������Һ,��������ϡ���ᣬˮԡ���Ⱥ�ȡ������Һ�����뼸������Cu(OH)2����Һ������ | ��Һ��δ����ש��ɫ���� | ����δˮ�� |
B | ��C��SiO2�Ĺ���������¼��� | 2C+SiO2 | �ǽ����ԣ�C>Si |
C | ��ʢ��2mL0.1mol/L��NaCl��Һ���Թ�����μ��뼸��0.1mol/L��AgNO3��Һ����ַ�Ӧ������μ���0.1mol/L��KI��Һ | ��ɫ������Ϊ��ɫ���� | Ksp(AgCl)>Ksp(AgI) |
D | �����Һ�м���������ϡNaOH��Һ����|ʪ�����ɫʯ����ֽ�����Թܿ� | ʪ�����ɫʯ����ֽδ��� | �ڴ���Һ�в�����NH4+ |
A. A B. B C. C D. D
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±�����ش�
ʵ���� | HA���ʵ���Ũ�� | NaOH���ʵ���Ũ�� | �����Һ��pH |
�� | 0.2 | 0.2 | pH=a |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH=9 |
��1���������������ʵ���������Ӽ�����������������a �������Һ��pH����˵��HA��ǿ�ỹ������ ��
��2���������������ʵ�����������������������C�Ƿ�һ������0.2��ѡ��ǡ��������Һ������Ũ��c��A������ c��Na+���Ĵ�С��ϵ�� ��
��3������ʵ����������HA���ᣨѡ�ǿ�������������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH����=molL��1 �� д���û����Һ��������ʽ�ľ�ȷ��������������Ƽ��㣩��c��Na+����c��A����=molL��1 c��OH������c��HA��=molL��1 ��