题目内容
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
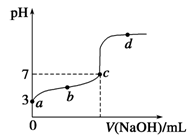

| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
A
试题分析:A、a点pH=3,说明CH3COOH溶液中c(H+)=10-3 mol?L?1,则c(CH3COO-)约为10-3 mol?L?1,正确;B、b点pH<7,说明c(H+)>c(OH?),根据电荷守恒可知:c(H+)+c(Na+)=c(OH?)+c(CH3COO?),可得c(Na+)<c(CH3COO?),错误;C、c点pH=7,因为CH3COONa水解显碱性,所以c点CH3COOH稍过量,错误;D、d点为反应pH变化曲线上的点,因为温度相同,所以
 等于K,错误。
等于K,错误。
练习册系列答案
相关题目


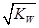 mol·L-1
mol·L-1