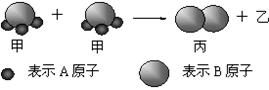
题目内容
已知某亚铁盐的化学式可表示为(NH4)a Feb(S04)c。取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g。另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100 mL 0.5mo1·L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5 mol·L-1NaOH溶液中和,需NaOH溶液40mL。该亚铁盐样品中b:c的比值为
| A.1:1 | B.2:1 | C.1:2 | D.3:2 |
C
试题分析:根据第一组反应计算硫酸根离子的量,n(SO42-)= n(BaSO4)=9.32÷233=0.04mol
根据第二组反应计算铵根离子的量,n(NH4+)=2n(H2SO4)=2(0.5×0.1-1.5×0.04÷2)=0.04mol
根据电荷守恒得2n(SO42-)= n(NH4+)+ 2n(Fe2+),n(Fe2+)=(0.04×2-0.04)÷2=0.02mol
所以b:c=0.02:0.04=1:2

练习册系列答案
相关题目