题目内容
相同条件下,质量相同的NH3和CH4,下列说法正确的是
| A.密度比为16:17 | B.氢原子比为3:4 |
| C.物质的量比为1:1 | D.体积比为16:17 |
B
试题分析:A、根据ρ=
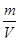 =
=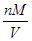 =
=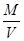 知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成正比,所以其密度之比=17:16,故A错误;B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;C、根据n=
知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成正比,所以其密度之比=17:16,故A错误;B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;C、根据n=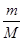 知,在质量相同的情况下,物质的量比为相对分子质量的反比,即物质的量比为16:17,故C错误;D、n=
知,在质量相同的情况下,物质的量比为相对分子质量的反比,即物质的量比为16:17,故C错误;D、n=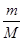 =
=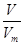 知,在相同条件下,气体的Vm相等,即体积之比等于相对分子质量之比,所以体积之比=17:16,故D错误。
知,在相同条件下,气体的Vm相等,即体积之比等于相对分子质量之比,所以体积之比=17:16,故D错误。
练习册系列答案
相关题目
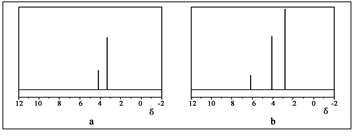
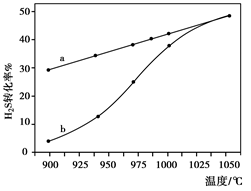
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。