题目内容
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
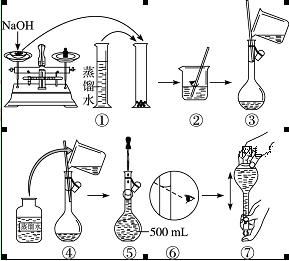
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为: (注明你的表达式中所用的有关符号的含义和单位)。
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为: (注明你的表达式中所用的有关符号的含义和单位)。
(1)电子天平(1分);250 mL的容量瓶(1分);
(2)2Na2SO3+ O2→ 2Na2SO4(1分)。
(3)使SO32-充分转化为气体,使SO42-完全沉淀(2分)静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。(1分)
(4)偏高(1分)
(5)<(1分),方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大(1分)。
(6)a(1分),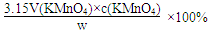 (V—mL,c—mol/L,数学式与答案各1分,2分)。
(V—mL,c—mol/L,数学式与答案各1分,2分)。
(2)2Na2SO3+ O2→ 2Na2SO4(1分)。
(3)使SO32-充分转化为气体,使SO42-完全沉淀(2分)静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。(1分)
(4)偏高(1分)
(5)<(1分),方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大(1分)。
(6)a(1分),
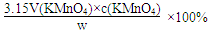 (V—mL,c—mol/L,数学式与答案各1分,2分)。
(V—mL,c—mol/L,数学式与答案各1分,2分)。试题分析:(1)配制一定体积准确浓度的溶液还少的仪器为电子天平(1分);250 mL的容量瓶(1分);
(2)写出Na2SO3固体氧化变为硫酸钠。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是使SO32-充分转化为气体,使SO42-完全沉淀,在过滤前,需要检验是否沉淀完全,其操作是静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。
(4)方案I中,若滤液浑浊,说明有部分硫酸钡损失了,将导致测定的硫酸钡质量偏低,那么亚硫钠的质量分数偏高。
(5)若操作正确,则m1< m2,原因是方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大。
(6)标准溶液相对性质要稳定,浓度基本保持稳定故 a.酸性KMnO4溶液可行。b.H2O2溶液易分解;c.Br2水易挥发;d.FeCl3溶液会水解,故都不行。根据关系式:2KMnO4------5Na2SO3固体的纯度可表示为:
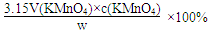 (V—mL,c—mol/L)
(V—mL,c—mol/L)
练习册系列答案
相关题目