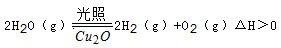题目内容
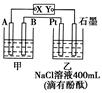
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。
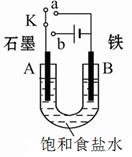
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
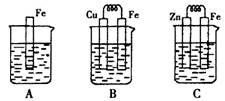
(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。

(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
Ⅰ:(1)Fe-2e-= Fe2+ (2) 2H+ +2e-= H2↑ Ⅱ:(3) 0.56g (4) Zn B>A>C
试题分析:Ⅰ:(1)若开始时开关K与a连接,则该装置为原电池。Fe电极为负极,发生反应:B Fe-2e-= Fe2+。(2)若开始时开关K与b连接,该装置为电解池。电极B极为阴极。由于在溶液中离子的放电能力:H+>Na+。所以在B电极上H+放电,电极反应式为2H+ +2e-= H2↑。Ⅱ:(3)B中总反应方程式为Fe+2H+=Fe2++ H2↑.n(H2)=0.224L÷22.4L/mol=0.01mol,则溶解的金属质量为0.01mol×56g/mol=0.56g. (4)由于金属活动性Zn>Fe,所以在该原电池装置中Zn为负极,非氧化而腐蚀,所以C中被腐蚀的金属是Zn。在金属腐蚀中,同种金属的腐蚀速率是原电池的负极大于一种金属单质大于原电池的正极。所以A、B、C中铁被腐蚀的速率,由快到慢的是顺序是B>A>C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Cu2O + H2↑。
Cu2O + H2↑。