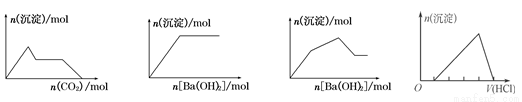
题目内容
某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
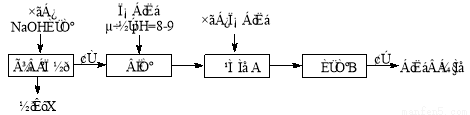
(1)镁铝合金中加NaOH溶液的离子反应方程式为 ,画出金属X的原子结构示意图 ,固体A的化学式为 ;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
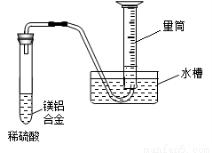
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、 。
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑[2分] Mg 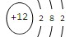 [2分]Al(OH)3 [1分]
[2分]Al(OH)3 [1分]
(2)Al2(SO4)3=2Al3++3SO42-[2分] 冷却结晶(降温结晶) [1分]
(3)氢气的体积、镁铝合金的质量(温度、大气压强)(答到前2个条件给满分)[各1分,共2分]
【解析】
试题分析:(1)镁铝合金中铝与NaOH溶液反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以X是镁,原子结构示意图为: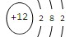 滤液为偏铝酸钠的溶液,加酸后生成氢氧化铝的沉淀,A为Al(OH)3
滤液为偏铝酸钠的溶液,加酸后生成氢氧化铝的沉淀,A为Al(OH)3
(2)硫酸铝是易溶强电解质,完全电离,Al2(SO4)3=2Al3++3SO42-,由溶液得到晶体需经过蒸发浓缩、冷却结晶(或降温结晶)、过滤、干燥
(3)测定镁铝合金中各组成的质量分数须知道外界条件、氢气的体积(即量筒内排出水的体积)、合金的质量
考点:考查离子方程式的书写、化学术语、分离提纯物质的方法及对实验数据的判断

练习册系列答案
相关题目