题目内容
【题目】在下面的装置中,A是实验室制备Cl2的发生装置,圆底烧瓶中盛放的是二氧化锰,C、D为气体净化装置;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶:烧杯G为尾气吸收装置。试回答:
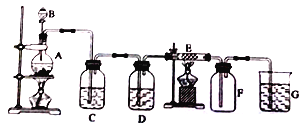
(1)C装置中试剂为______。
(2)E中的现象为______。
(3)写出在A、G中发生反应的离子方程式:A: ___________。G: ________________。
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2 KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①考试用“单线桥”标出电子转移的方向和数目: __________。
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20mL、12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到氯气在标准状况下的体积为_______。
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L
【答案】 饱和食盐水 棕黄色的烟 Mn02+4H++2Cl-(浓) ![]() Mn2++Cl2↑+2H2O Cl2+2OH-=Cl-+ClO-+H2O
Mn2++Cl2↑+2H2O Cl2+2OH-=Cl-+ClO-+H2O  5:3 D
5:3 D
【解析】本题考查实验方案设计的评价,(1)装置A制取氯气,氯气中混有水蒸气和HCl,应先除去HCl,后除去水蒸气,除去氯气中的HCl,通过饱和食盐水,即装置C中盛放的是饱和食盐水;(2)装置E中发生铁和氯气的反应,产生棕黄色的烟;(3)装置A中制取氯气,离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,装置G的作用是吸收未反应的氯气,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;(4)①根据反应方程式,KMnO4中Mn的化合价降低,HCl中Cl的化合价升高,消耗2molKMnO4转移电子10e-,应从HCl中Cl出来,箭头指向KMnO4中Mn,即为
Mn2++Cl2↑+2H2O,装置G的作用是吸收未反应的氯气,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;(4)①根据反应方程式,KMnO4中Mn的化合价降低,HCl中Cl的化合价升高,消耗2molKMnO4转移电子10e-,应从HCl中Cl出来,箭头指向KMnO4中Mn,即为 ;②被氧化HCl的物质的量,看Cl2中Cl的物质的量,即被氧化的HCl物质的量为10mol,未被氧化HCl,看生成物中Cl-的物质的量,即未被氧化HCl的物质的量为6mol,因此两者的比值为10:6=5:3;假设HCl全部参加反应,根据反应方程式,生成氯气的体积为20×10-3×12×5×22.4/16L=1.68L,因为高锰酸钾溶液与浓盐酸反应,随着反应的进行,盐酸浓度变稀,到达某一浓度反应停止,产生Cl2的体积小于1.68L。
;②被氧化HCl的物质的量,看Cl2中Cl的物质的量,即被氧化的HCl物质的量为10mol,未被氧化HCl,看生成物中Cl-的物质的量,即未被氧化HCl的物质的量为6mol,因此两者的比值为10:6=5:3;假设HCl全部参加反应,根据反应方程式,生成氯气的体积为20×10-3×12×5×22.4/16L=1.68L,因为高锰酸钾溶液与浓盐酸反应,随着反应的进行,盐酸浓度变稀,到达某一浓度反应停止,产生Cl2的体积小于1.68L。

