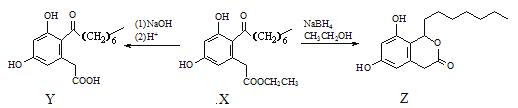
题目内容
【题目】保持洁净安全的生存环境已成为全人类的共识。
(1)某日空气中各种污染物的污染指数分别为:二氧化硫66,二氧化氮50,可吸入颗粒120。该地区的当日首要污染物是 。
(2)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。写出CO与NO反应的化学方程式: 。
(3)pH< 的雨水称为酸雨;向煤中加入适量的 ,可以大大减少燃物产物中SO2的量。
(4)1998年我国长江流域发生百年一遇的洪水,洪水泛滥期间为解决灾民的饮用水问题,防疫人员向灾民发放明矾来净化河水。明矾的净水原理是 (用有关反应的离子方程式表示)。
【答案】
(1)可吸入颗粒物;
(2)2NO+2CO![]() N2+2CO2;
N2+2CO2;
(3)5.6;CaCO3(或CaO);
(4)Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
【解析】
试题分析:(1)二氧化硫86,二氧化氮71,可吸入颗粒物162,污染指数的数值最大的是可吸入颗粒物,故答案为:可吸入颗粒物;
(2)“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为2NO+2CO![]() N2+2CO2,故答案为:2NO+2CO
N2+2CO2,故答案为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
(3)空气中含有二氧化碳,二氧化碳能和雨水反应生成碳酸,碳酸显酸性,所以正常的雨水常呈微酸性,pH约为5.6;而二氧化硫、氮氧化物是形成酸雨的重要物质,其溶液的pH<5.6,会形成酸雨;向煤中加入适量的CaCO3(或CaO),高温下石灰石分解生成CaO,可与SO2以及氧气反应生成硫酸钙,发生的反应为:2CaCO3+2SO2+O2![]() 2CO2+2CaSO4,可以大大减少燃物产物中SO2的量,故答案为:5.6;CaCO3(或CaO);
2CO2+2CaSO4,可以大大减少燃物产物中SO2的量,故答案为:5.6;CaCO3(或CaO);
(4)明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解Al3++3H2O![]() Al(OH)3(胶体)+3H+,生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性净水,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性净水,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案