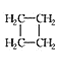题目内容
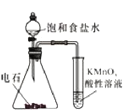
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下可分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系,若溶液中只有NaCl、NaClO、NaClO3三种溶质。下列判断不正确的是
A.反应过程中消耗氯气与NaOH的物质的量之比为1:2
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:11:2
C.若反应过程中消耗lmol氯气,则1mol<转移电子<![]() mol
mol
D.溶液中c(Na+)和c(Cl-)之比可能为5:2
【答案】D
【解析】
A. 根据题意,氯气和NaOH反应生成NaCl、NaClO、NaClO3,得出钠原子的物质的量等于氯原子的物质的量,即n(NaOH)=n(Na+)=n(Cl)=![]() n(Cl2),消耗氯气的物质的量与NaOH的物质的量之比为1:2,故A说法正确;
n(Cl2),消耗氯气的物质的量与NaOH的物质的量之比为1:2,故A说法正确;
B. 根据化合价,NaCl为还原产物,NaClO、NaClO3为氧化产物,假设生成11molNaCl,转移电子物质的量为11mol,生成1molNaClO和2molNaClO,转移电子物质的量为(1mol×1+2mol×5)=11mol,得失电子数目守恒,反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:11:2,故B说法正确;
C. 假设生成NaCl和NaClO,消耗1molCl2,转移1mol电子,假设生成NaCl和NaClO3,消耗1molCl2,转移电子物质的量为![]() mol,因此生成NaCl、NaClO、NaClO3过程中消耗1molCl2,则1mol<转移电子<
mol,因此生成NaCl、NaClO、NaClO3过程中消耗1molCl2,则1mol<转移电子<![]() mol,故C说法正确;
mol,故C说法正确;
D. 若只发生Cl2+2NaOH=NaCl+NaClO+H2O,n(Na+):n(Cl-)=2:1,若只发生3Cl2+6NaOH=5NaCl+NaClO3+3H2O,n(Na+):n(Cl-)=6:5,该比值的范围是![]() ,5:2不在该范围内,故D说法错误;
,5:2不在该范围内,故D说法错误;
答案:D。

 名校课堂系列答案
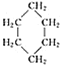
名校课堂系列答案【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下表是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
结构简式 |
|
|
|
键线式 |
|
|
|
①![]() +H2
+H2![]()
![]()
②![]() +H2
+H2![]()
![]()
③![]() +H2
+H2![]()
![]()
④![]() +KMnO4
+KMnO4![]()
![]() +
+![]() +Mn2+
+Mn2+
回答下列问题:
(1)环烷烃与___________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是______(填名称),判断依据为_________。
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件反应,其化学方程式为(不需注明反应条件)____________。
(4)写出鉴别环丙烷与丙烯的一种方法:试剂___________;现象与结论 __________。
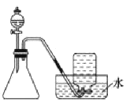
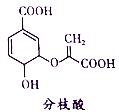
【题目】二正丁基锡羧酸酯是一种良好的大肠杆菌,枯草杆菌的杀菌剂。合成一种二正丁基锡羧酸酯的方法如图1:

将0.45g的2-苯甲酰基苯甲酸和0.500g的二正丁基氧化锡加入到50mL苯中,搅拌回流分水6小时。水浴蒸出溶剂,残留物经重结晶得到白色针状晶体。
各物质的溶解性表
物质 | 水 | 苯 | 乙醇 |
2-苯甲酰基苯甲酸 | 难溶 | 易溶 | 易溶 |
二正丁基氧化锡 | 难溶 | 易溶 | 易溶 |
正丁基锡羧酸酯 | 难溶 | 易溶 | 易溶 |
回答下列问题:
(1)仪器甲的作用是___,其进水口为___。
(2)实验不使用橡胶塞而使用磨口玻璃插接的原因是___。
(3)分水器(乙)中加蒸馏水至接近支管处,使冷凝管回流的液体中的水冷凝进入分水器,水面上升时可打开分水器活塞放出,有机物因密度小,位于水层上方,从分水器支管回流入烧瓶。本实验选用的分水器的作用是__(填标号)
A.能有效地把水带离反应体系,促进平衡向正反应方向移动
B.能通过观察水面高度不再变化的现象,判断反应结束的时间
C.分离有机溶剂和水
D.主要起到冷凝溶剂的作用
(4)回流后分离出苯的方法是__。
(5)分离出苯后的残留物,要经重结晶提纯,选用的提纯试剂是__(填标号)
A.水 B.乙醇 C.苯
(6)重结晶提纯后的质量为0.670g,计算二正丁基锡羧酸酯的产率约为__。