题目内容
【题目】元素周期表第四周期的8、9、10列元素为X、Y、Z,它们的化合物在生产生活中有着广泛的应用。回答下列问题(涉及的化学式用元素符号表示)
(1)基态X原子的价电子排布式为______________________,Z2+核外3d能级上有___________对成对电子。
(2)Y3+的一种配离子[Y(N3) (NH3)5]2+中,Y3+的配位数是___________,lmol配离子中所含σ键的数目为___________,配位体N3-中心原子杂化类型为______________________。
(3)Y2+在水溶液中以[Y(H2O)6]2+存在。向含Y2+的溶液中加入过量氨水可生成更稳定的[Y(NH3)6]2+,其原因是____________________________________________。
(4)X离子与KCN形成的蓝色晶体中,X2+、X3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为______________________,立方体中X2+间连接起来形成的空间构型是____________________。
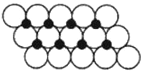
(5)一定温度下,ZO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Z2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为___________g(用含a、NA的代数式表示)。
【答案】3d64s2 3 6 23NA sp N元素电负性比O元素小,N原子更容易提供孤电子对,形成配位键更稳定 KFe2(CN)6 正四面体形 ![]() 或
或![]()
【解析】
元素周期表第四周期的8、9、10列元素为X、Y、Z,推出X为Fe,Y为Co,Z为Ni,然后进行分析;
元素周期表第四周期的8、9、10列元素为X、Y、Z,推出X为Fe,Y为Co,Z为Ni,
(1)基态Fe原子价电子是由最外层s能级和次外层d能级组成,则基态Fe原子价电子排布式为3d64s2;Ni2+的价电子排布式为3d8,有3对成对电子;
(2)该配离子为[Co(N3)(NH3)5]2+,Co3+的配位数为6,成键原子之间只能形成一个σ键,1mol该配离子含有σ键的数目是23NA;N3-可以看作是(NN2)-,有2个σ键,孤电子对数为(5+1-2×3)/2=0,杂化类型为sp;
(3)N元素电负性比O元素小,N原子更容易提供孤电子对,形成配位键更稳定;
(4)晶胞中Fe2+个数为4×1/8=1/2,Fe3+的个数为4×1/8=1/2,CN-个数为12×1/4=3,根据化合价代数和为0,则K+个数为1/2,即该晶体的化学式为KFe2(CN)6;Fe2+间接连起来,构成空间构型为正四面体形;
(5)建立如图所示结构,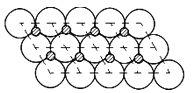 ,每个氧化镍所占的面积为2a×10-12×2a×10-12×sin60°m2,质量为75/NAg,因此每平方米含有的氧化镍的质量为
,每个氧化镍所占的面积为2a×10-12×2a×10-12×sin60°m2,质量为75/NAg,因此每平方米含有的氧化镍的质量为![]() 或
或![]() 。
。