题目内容
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
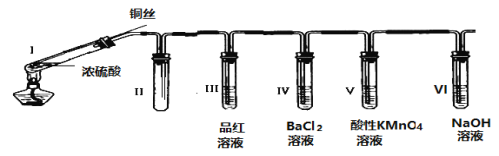
请回答:
(1)连接好装置后,接下来的操作步骤是________________
(2)浓硫酸与铜丝反应的化学方程式为________________
(3)装置II的作用是________________
(4)下列说法正确的是________________
A 反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色
B 试管III、V中溶液都会褪色,其褪色原理相同
C 取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4
D 试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替
(5)某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是________________
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
【答案】气密性检查 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 防止倒吸 ACD BC
CuSO4+SO2↑+2H2O 防止倒吸 ACD BC
【解析】
Ⅰ中浓硫酸和铜在加热条件下反应生成二氧化硫,II为防倒吸装置,IⅡ中品红褪色,二氧化硫与氯化钡不反应,IV中无现象,若振荡,可被空气中氧气氧化生成硫酸钡,V中二氧化硫可使高锰酸钾褪色,VI用于吸收二氧化硫,防止污染环境
(1)反应生成气体,且有气体参加反应,则连接好装置后,应检查装置的气密性;
(2)铜与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)装置II为安全瓶,用于防止倒吸;
(4)A.反应后,将试管Ⅰ生成硫酸铜,加入水中,溶液呈蓝色,故A正确;
B.试管III褪色与二氧化硫的漂白性有关,V中溶液褪色与二氧化硫的还原性有关,其褪色原理不同,故B错误;
C.取下试管Ⅲ并不断振荡,亚硫酸可被氧化生成硫酸,试管中出现浑浊,是因为生成了BaSO4,故C正确;
D.碳酸钠溶液呈碱性,可吸收二氧化硫,反应生成亚硫酸钠,故D正确。
故答案为:ACD;
(5)如硫酸有剩余,则溶液呈酸性,加入铁粉、NaHCO3溶液,可生成气体,稀硫酸与Ag不反应,
故答案为:BC。