��Ŀ����
����Ŀ��������ԭ��Ӧ�������������о��й㷺����;���ᴩ�Ž�
��1��ˮ���������Ҫ��ɲ��֣��������к�������һ�����ʣ��������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��Ҳ����ͼ1�����д����ˮ�μӵķ��Ϸ�Ӧ���͢���һ����ѧ����ʽ�� �� ����ˮΪ����
��2��������������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڣ�����˫��ˮ���ش��������⣺ �����з�Ӧ�У�H2O2�����������������ֻ�ԭ�Եķ�Ӧ��
A��Na2O2+2HCl�T2NaCl+H2O2 B��Ag2O+H2O2�T2Ag+O2��+H2O
C��2H2O2�T2H2O+O2�� D��3H2O2+Cr2��SO4��3+10KOH�T2K2CrO4+3K2SO4+8H2O
�ڱ������������Լ�ƿ�����ʺ����ϵ�һ����ǩ��ͼ2��������ţ�
��3������ͭ��ʱ��������NH4Cl ��ȥ����������ͭ�ٽ��к��ӣ��÷�Ӧ�ɱ�ʾΪ��4CuO+2NH4Cl ![]() 3Cu+CuCl2+N2��+4H2O ����˫���ű�������ת�Ƶķ������Ŀ ��
3Cu+CuCl2+N2��+4H2O ����˫���ű�������ת�Ƶķ������Ŀ ��
�ڸ÷�Ӧ�У���������Ԫ���� �� �������� ��
�ۻ�ԭ����������������ʵ���֮��Ϊ ��
�ܷ�Ӧ��������0.2mol�ĵ���������mol�ĵ���ת�ƣ�
���𰸡�
��1��2Na+2H2O=2NaOH+H2��������
��2��C��B
��3��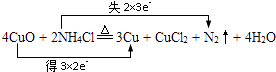 ��N��CuO��2:1��1.2
��N��CuO��2:1��1.2
���������⣺��1����ͼ��֪����Ϊ������ԭ��Ӧ���������û���Ӧ����2Na+2H2O=2NaOH+H2����ˮ��HԪ�صĻ��ϼ۽��ͣ���ˮΪ�����������Դ��ǣ�2Na+2H2O=2NaOH+H2������������2����A��Na2O2+2HCl�T2NaCl+H2O2�У���������Ϊ�����B��Ag2O+H2O2�T2Ag+O2��+H2O��OԪ�صĻ��ϼ����ߣ�ֻ���ֹ�������Ļ�ԭ�ԣ� C��2H2O2�T2H2O+O2����HԪ�صĻ��ϼ۽��ͣ�OԪ�صĻ��ϼ����ߣ������������Ժͻ�ԭ�ԣ�D��3H2O2+Cr2��SO4��3+10KOH�T2K2CrO4+3K2SO4+8H2O��OԪ�صĻ��ϼ۽��ͣ�ֻ���ֹ�������������ԣ����Դ��ǣ�C����˫��ˮ�����������������������ԣ������ñ�ǩB�����Դ��ǣ�B����3����Cu��+2�۽���Ϊ0��NԪ�صĻ��ϼ��ɩ�3������Ϊ0���÷�Ӧת��6e�� �� ��˫���ű�������ת�Ƶķ������ĿΪ  �����Դ��ǣ�
�����Դ��ǣ�  ����NԪ�صĻ��ϼ�����ʧȥ���ӱ�������CuԪ�صĻ��ϼ۽��ͣ���CuOΪ�����������Դ��ǣ�N��CuO���ۻ�ԭ��ΪNH4Cl����������ΪN2 �� �ɷ�Ӧ��֪����ԭ����������������ʵ���֮��Ϊ2��1�����Դ��ǣ�2��1�����ɷ�Ӧ��֪������1mol����ת��6mol���ӣ������0.2mol������ת�Ƶĵ���Ϊ0.2mol��6mol=1.2mol�����Դ��ǣ�1.2��
����NԪ�صĻ��ϼ�����ʧȥ���ӱ�������CuԪ�صĻ��ϼ۽��ͣ���CuOΪ�����������Դ��ǣ�N��CuO���ۻ�ԭ��ΪNH4Cl����������ΪN2 �� �ɷ�Ӧ��֪����ԭ����������������ʵ���֮��Ϊ2��1�����Դ��ǣ�2��1�����ɷ�Ӧ��֪������1mol����ת��6mol���ӣ������0.2mol������ת�Ƶĵ���Ϊ0.2mol��6mol=1.2mol�����Դ��ǣ�1.2��

����Ŀ�������������ڹ�ũҵ����������Ҫ���á�
��1������N2H4�����ֳ����ĵ��⻯�����֪��
4NH3��g��+3O2��g��![]() 2N2��g��+6H2O��g����H1=-541.8kJ��mol-1
2N2��g��+6H2O��g����H1=-541.8kJ��mol-1
N2H4��g��+O2��g��![]() N2��g��+2H2O��g����H2=-534kJ��mol-1
N2��g��+2H2O��g����H2=-534kJ��mol-1
��NH3��g����O2��g����ȡN2H4��g�����Ȼ�ѧ����ʽΪ_______________
��2������������һ���������ܷ������·�Ӧ��
NO2��g��+SO2��g��![]() SO3��g��+NO��g�� ��H=-42kJ��mol-1
SO3��g��+NO��g�� ��H=-42kJ��mol-1
�����Ϊ2L�ĺ����ܱ������г���SO2��g����NO2��g����ʵ�������������£�
ʵ���� | �¶� | ��ʼ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n��SO2�� | n��NO2�� | n��NO�� | ||
�� | T1 | 4 | 2 | 0.8 |
�� | T2 | 2 | 4 | 0.6 |
�� | T1 | 2 | 1 | a |
����ʵ����У���2minʱ��÷ų���������8.4kJ�����¶��µ�ƽ�ⳣ��Ϊ_______��������С�������λ��
���ɱ������ݿ���֪T1_____T2������������������=����
��ʵ����У��ﵽƽ��ʱNO2��ת����Ϊ_______
��3��ʹ�ü�ӵ绯ѧ�����Դ���ú�����е�NO����Ӧԭ������ͼ��ʾ����֪������Һ��pH��4-7֮�䣬д�������ĵ缫��Ӧʽ____________________��





