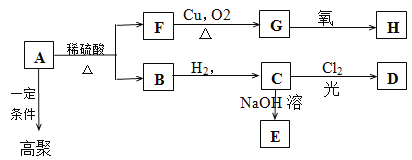
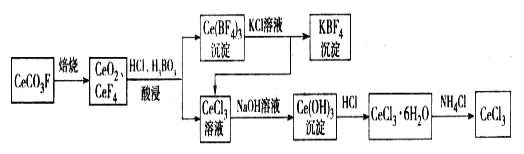
题目内容
【题目】钠及其化合物具有广泛的用途。
(1)工业上制备碳酸氢钠的化学方程式为____________。
(2)用Na2CO3熔融作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示,正极的电极反应式为__________。

(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是_______,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当100 mL 2mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH<7,则溶液中各离子浓度由大到小的顺序为_______。
②常温下,已知Ksp[Cu(OH)2]=2×10-20, Ksp[CuS]=1.3×10-36。向浓度为0.1mol/L,体积为10mL的氢氧化钠溶液中,逐滴加入浓度为0.1mol/L 硫酸铜溶液至pH=6时Cu2+的浓度为______。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,_______(填“有”或“没有”)CuS沉淀析出。(一滴约为0.05mL)
【答案】 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl O2+4e-+2CO2=2CO32- CO32- c c(Na+)>c(HSO3-)>c(H+) >c(SO32-)>c(OH-) 2×10-4 有
【解析】(1) 工业上制备碳酸氢钠的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;(2)该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-;(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、HCO3-四种酸的酸性大小顺序是CH3COOH>HClO>HCN>HCO3-,所以溶液的pH变化最大的是醋酸,答案选c;(4)①100mL2molL-1的NaOH的物质的量=2mol/L×0.1L=0.2mol,标准状况下4.48LSO2的物质的量=![]() =0.2mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH= NaHSO3,由于水解程度小于电离程度,所以溶液中各离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);②pH=6时氢氧根浓度是10-8mol/L,则Cu2+的浓度为
=0.2mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH= NaHSO3,由于水解程度小于电离程度,所以溶液中各离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);②pH=6时氢氧根浓度是10-8mol/L,则Cu2+的浓度为![]() 。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,硫离子浓度是
。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,硫离子浓度是![]() ,此时浓度熵=0.0005×2×10-4>Ksp[CuS],因此有CuS沉淀析出。
,此时浓度熵=0.0005×2×10-4>Ksp[CuS],因此有CuS沉淀析出。

 阅读快车系列答案
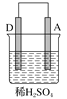
阅读快车系列答案【题目】由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象 | |||
装置 | 甲 | 乙 | 丙 |
|
|
| |
现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
A. 装置甲中的B金属是原电池的负极
B. 装置乙中的C金属是原电池的阴极
C. 装置丙中的D金属是原电池的正极
D. 四种金属的活泼性顺序是D>A>B>C