题目内容
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
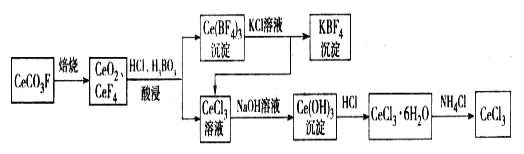
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_________。
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,优点为____________;写出稀硫酸、H2O2与CeO2反应的离子方程式:______________。
(3)写出Ce(BF4)3中加入KCl溶液反应的离子方程式:__________。
(4)化学家研究发现,SbF5能将MnF4从离子[SbF6]2-的盐反应得到,SbF5转化成稳定离子[SbF6]-的盐。而SbF4很不稳定,受热易分解为SbF3和F2。根据据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:______________________。
现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。 已知KHF2是一种酸式盐,写出阴极上发生的电极反应式_______。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
(5)已知25 ℃时,HF的电离平衡常数Ka=3.6×10-4,CaF2的溶解积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________。
【答案】 +3 避免产生Cl2,不会造成环境污染 H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑ Ce(BF4)3+3K+=== 3K BF4+Ce3+ 2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑ 2HF
4KSbF6+2MnF3+F2↑ 2HF![]() +2e-===H2↑+4F- 氟气和氢气能发生剧烈反应,引发爆炸 c(H+)=c(F-)=
+2e-===H2↑+4F- 氟气和氢气能发生剧烈反应,引发爆炸 c(H+)=c(F-)=![]() mol·L-1=6×10-3mol·L-1,c(Ca2+)=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀。
mol·L-1=6×10-3mol·L-1,c(Ca2+)=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀。
【解析】本题考查物质制备工艺流程图分析、离子方程式的书写等、电解池、溶度积的应用等。
(1)根据化合物中元素化合价代数和为零可知,Ce元素在CeCO3F化合价为+3;(2)CeO2将盐酸中Cl—氧化为Cl2,对环境产生污染;若改为稀硫酸和H2O2,CeO2在酸性条件下将中H2O2氧化为O2,避免产生Cl2,不会造成环境污染,其离子方程为 H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑;(3)根据流程可知Ce(BF4)3中加入KCl生成KBF4沉淀和CeCl3溶液,故其离子反应方程式为:Ce(BF4)3+3K+=== 3KBF4+Ce3+;(4)结合题中信息“SbF5转化成稳定离子[SbF6]-的盐”和“SbF4很不稳定,受热易分解为SbF3和F2”,故K2MnF6和SbF5为原料,在423 K 的温度下制备F2的化学方程式为:2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑;电解池阴极发生还原反应,化合价降低,电解池装置图可知,阴极产生氢气,故阴极的电极反应式为:2HF
4KSbF6+2MnF3+F2↑;电解池阴极发生还原反应,化合价降低,电解池装置图可知,阴极产生氢气,故阴极的电极反应式为:2HF![]() +2e-===H2↑+4F-;电解制氟时,阳极产生的气体为F2,与阴极产生的氢气能发生剧烈反应,在暗处就能爆炸,因此电解制氟时,要用镍铜合金隔板将两种气体产物严格分开;(5)HF
+2e-===H2↑+4F-;电解制氟时,阳极产生的气体为F2,与阴极产生的氢气能发生剧烈反应,在暗处就能爆炸,因此电解制氟时,要用镍铜合金隔板将两种气体产物严格分开;(5)HF![]() H++F—,由电离常数可知:c(H+)=c(F-)=
H++F—,由电离常数可知:c(H+)=c(F-)=![]() mol·L-1=6×10-3mol·L-1,混合液中:c(Ca2+)=
mol·L-1=6×10-3mol·L-1,混合液中:c(Ca2+)=![]() =0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀。
=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀。

 小学课时特训系列答案
小学课时特训系列答案【题目】钠及其化合物具有广泛的用途。
(1)工业上制备碳酸氢钠的化学方程式为____________。
(2)用Na2CO3熔融作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示,正极的电极反应式为__________。

(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是_______,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当100 mL 2mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH<7,则溶液中各离子浓度由大到小的顺序为_______。
②常温下,已知Ksp[Cu(OH)2]=2×10-20, Ksp[CuS]=1.3×10-36。向浓度为0.1mol/L,体积为10mL的氢氧化钠溶液中,逐滴加入浓度为0.1mol/L 硫酸铜溶液至pH=6时Cu2+的浓度为______。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,_______(填“有”或“没有”)CuS沉淀析出。(一滴约为0.05mL)
