题目内容
(14分)根据下图所示的转化关系填空(假设每一步反应的反应物均恰好反应完)
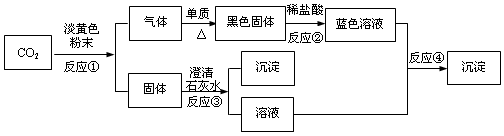
(1)写出反应①的化学方程式: 。
此反应中,氧化剂与还原剂的个数比为 。当有3.2 g气体产生时,消耗淡黄色固体的物质的量是_______mol,固体增重_______g;
(2)写出反应②、③、④的离子方程式:
②
③
④

(1)写出反应①的化学方程式: 。
此反应中,氧化剂与还原剂的个数比为 。当有3.2 g气体产生时,消耗淡黄色固体的物质的量是_______mol,固体增重_______g;
(2)写出反应②、③、④的离子方程式:
②
③
④
(1)2Na2O2+2CO2=2Na2CO3+O2; 1︰1; 0.2, 5.6;
(2)CuO+2H+=Cu2++H2O Ca2++CO32-=CaCO3↓ Cu2++2OH-=Cu(OH)2↓
(2)CuO+2H+=Cu2++H2O Ca2++CO32-=CaCO3↓ Cu2++2OH-=Cu(OH)2↓
试题分析:能和CO2反应的淡黄色粉末应该是过氧化钠。过氧化钠和CO2反应生成氧气和碳酸钠。碳酸钠和澄清的石灰水反应生成碳酸钙白色沉淀和氢氧化钠。根据反应②生成的是蓝色溶液可知,该溶液中含有铜离子,所以单质是铜,黑色固体是氧化铜。氧化铜和盐酸反应生成氯化铜,氯化铜和氢氧化钠反应生成蓝色沉淀氢氧化铜。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,难度不大,学生不难得分。解框图题的关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目



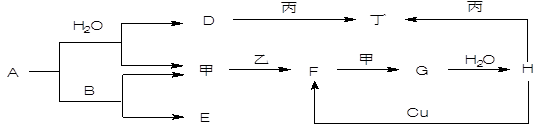

 请回答下列问题:
请回答下列问题:
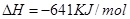


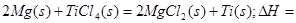 ____________
____________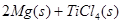

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________

