题目内容
15.下列混合物分离可用蒸馏法的是( )| A. | 分离饱和食盐水与沙子的混合物 | |
| B. | 分离水和汽油的混合物 | |
| C. | 分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物. | |
| D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 |
分析 根据混合物中各物质溶解性、沸点、被吸附性能及在不同溶剂中溶解性的不同,可以选用过滤和结晶、蒸馏(或分馏)、加热分解、萃取和分液等方法进行分离和提纯,可参照下表采取分离方法.
| 分离提纯方法 | 适用范围 |
| 过滤 | 固体与液体不互溶的混合物 |
| 结晶与重结晶 | 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 |
| 蒸馏(分馏) | ①难挥发的固体杂质在液体中形成的混合物②互溶液体沸点有明显差异 |
| 加热分解 | 分离加热易分解的物质 |
| 分液 | 两种互不混溶的液体混合物 |
| 萃取 | 溶质在互不相溶的溶剂里溶解度不同 |
解答 解:A.沙子不溶于水,食盐溶于水,可用过滤法分离沙子和溶液,故A错误;
B.水和汽油互不相溶,可用分液的方法分离,故B错误;
C.四氯化碳与甲苯的沸点不同,可用蒸馏的方法分离,故C正确;
D.硝酸钾和氯化钠在溶液中的溶解度随温度变化程度不同,可用结晶法分离,故D错误;
故选C.
点评 本题考查物质的分离,侧重于学生的实验能力的考查,为高考常见题型,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
相关题目
5.3molA和2.5molB混合于2L密闭容器中,发生的反应如下:3A(g)+B(g)?xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L•min),下列结论正确的是( )
| A. | A的平均反应速率为 0.1 mol/(L•min) | |
| B. | 平衡时,C的浓度为 0.125 mol/L | |
| C. | 平衡时,B的转化率为 20% | |
| D. | 平衡时,容器内压强为原来的 0.8 倍 |
3.下列物质中,既能跟NaOH反应,又能跟盐酸反应的是( )
| A. | (NH4)2 SO4 | B. | Al(OH)3 | C. | NaHSO4 | D. | Mg(NO3)2 |
10.胶体分散系与其它分散系的本质区别是( )
| A. | 分散质粒子大小 | B. | 是否有丁达尔现象 | ||
| C. | 是否稳定 | D. | 分散质粒子是否带电 |
7.下列反应属氧化还原的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | H2+Cl2═HCl | C. | Na2O+H2O═2NaOH | D. | NH3+HCl═NH4Cl |
4.下列事故或药品的处理正确的是( )
| A. | 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 制取并收集氧气结束后,应立即停止加热 | |
| C. | 当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处 | |
| D. | 将含硫酸的废液倒入水槽,用水冲入下水道 |
5.在通风橱中进行下列实验:
下列说法中不正确的是( )
| 步骤 | 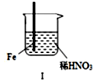 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 | |
| B. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| C. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
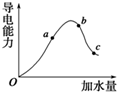 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: