题目内容
已知温度T时水的离子积常数为Kω。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b | B.混合溶液的pH=7 |
C.混合溶液中,c(H+) =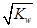 mol/L mol/L | D.向反应后的混合液中滴加石蕊试液后呈紫色 |
C
试题分析:溶液的酸碱性只与溶液中氢离子浓度和OH-浓度的相对大小有关系,只要溶液中氢离子浓度和OH-浓度消毒,溶液就一定先中性,据此可以判断。A、a=b说明二者恰好反应,但不能确定酸碱的强弱,因此生成的盐是否水解不能确定,所以无法确定溶液是否显中性,A不正确;B、由于不能确定温度,所以混合溶液的pH=7不能说明溶液显中性,B不正确;C、根据水的离子积常数表达式Kω=c(H+)·c(OH-)可知,如果混合溶液中,c(H+) =
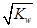 mol/L,则溶液中c(H+)=c(OH-),因此溶液显中性,C正确;D、由于石蕊试液的变色范围是5.0~8.0,所以向反应后的混合液中滴加石蕊试液后呈紫色,只能说明溶液的pH介于5.0~8.0之间,但不能说明溶液显中性,D不正确,答案选C。
mol/L,则溶液中c(H+)=c(OH-),因此溶液显中性,C正确;D、由于石蕊试液的变色范围是5.0~8.0,所以向反应后的混合液中滴加石蕊试液后呈紫色,只能说明溶液的pH介于5.0~8.0之间,但不能说明溶液显中性,D不正确,答案选C。
练习册系列答案
相关题目