题目内容
【题目】工业生产的纯碱常含有少量的NaCl等杂质。如图是测定产品中Na2CO3质量分数的实验装置。操作步骤如下:
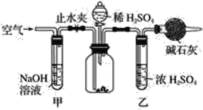
A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为Wg
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是______________________________________。
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是________________,装置甲的作用是______________________________,装置乙的作用是___________________________。
(3)计算样品中Na2CO3的质量分数的计算式是______________。
(4)若去掉装置甲,测定结果会______________;若去掉装置乙,测定结果会__________。(填“偏大”、“偏小”或“无影响”)
【答案】C→B→E→H→D→A→G→E→F 使广口瓶中产生的CO2气体全部排出 吸收空气中的CO2 吸收CO2中的水蒸气 ![]() ×100% 偏大 偏大
×100% 偏大 偏大
【解析】
(1)根据反应的原理,结合题干选项中的提示解答,C→E间须装样品选B,E→D间须通入空气将装置内的二氧化碳完全排出选H,D→G间须在干燥管内填满碱石灰,增加的质量即为二氧化碳的质量,选A,G→F须打开止水夹,选E,据此解答;
(2)装置中残留生成的二氧化碳,不将二氧化碳排尽,会影响测定的二氧化碳的质量,计算样品中碳酸钠的质量;
(3)由实验目的可知,反应生成的二氧化碳的质量为(w-m)g,计算二氧化碳的物质的量,根据碳元素守恒二氧化碳的物质的量等于样品中碳酸钠的物质的量,计算样品中碳酸钠的质量,再利用质量分数的定义进行求解;
(4)装置甲中装有氢氧化钠,氢氧化钠吸收二氧化碳,可除掉空气中的二氧化碳;如果不除去气体中的二氧化碳,会使干燥管中测定的二氧化碳的质量增大;从广口瓶中产生导出的气体中含有水,如果不除去气体中的水,会使干燥管中测定的二氧化碳的质量增大.
(1)为了保证实验的顺利进行,避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品,避免装置漏气影响实验效果,所以第一步须检查装置气密性,然后装药品,实验装置中会残留空气中的二氧化碳,影响干燥管中二氧化碳质量的测定,需要通入气体将装置内的二氧化碳完全排出,通的空气通过氢氧化钠,吸收了二氧化碳后不影响实验的气体排装置中会残留空气,然后在干燥管内填满碱石灰,缓慢加入稀硫酸至不再产生气体为止,缓缓鼓入空气数分钟,使广口瓶中的产生的二氧化碳气体全部排出,
故答案为:C→B→E→H→D→A→G→E→F;
(2)稀硫酸和碳酸钠反应生成二氧化碳和硫酸钠和水,测定产品中Na2CO3质量分数,是通过测定稀硫酸和碳酸钠生成物中的二氧化碳的量,根据碳元素守恒,测定样品中碳酸钠质量分数,步骤F中,要缓缓鼓入空气数分钟,使广口瓶中的产生的二氧化碳气体全部排出;装置甲中装有氢氧化钠,氢氧化钠吸收二氧化碳,除掉空气中的二氧化碳;装置乙中装有浓硫酸,浓硫酸具有吸水性,能吸收二氧化碳中的水蒸气,
故答案为:使广口瓶中的产生的二氧化碳气体全部排出;吸收空气中的二氧化碳;吸收二氧化碳中的水蒸气;
(3)由题意可知,反应生成的二氧化碳的质量为(w-m)g,二氧化碳的物质的量n=![]() ,根据碳元素守恒可知样品中碳酸钠的物质的量n=
,根据碳元素守恒可知样品中碳酸钠的物质的量n=![]() ,样品中碳酸钠的质量为m=n×M=
,样品中碳酸钠的质量为m=n×M=![]() ,样品中碳酸钠质量分数为
,样品中碳酸钠质量分数为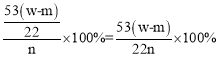 ,故答案为:
,故答案为:![]() ;
;
(4)装置甲中装有氢氧化钠,氢氧化钠吸收二氧化碳,可除掉空气中的二氧化碳,鼓入空气数分钟,使广口瓶中的产生的二氧化碳气体全部排出,若去掉装置甲,空气中的二氧化碳未除去,装置中二氧化碳的质量增大,会使干燥管中测定的二氧化碳的质量增大,导致测定的样品中碳酸钠的质量增大;从广口瓶中产生导出的气体中含有水,如果不除去气体中的水,会使干燥管中测定的二氧化碳的质量增大,计算样品中碳酸钠的质量是根据碳元素守恒二氧化碳的物质的量等于样品中碳酸钠的物质的量进行计算的,所以会导致测定的样品中碳酸钠的质量增大,测定的碳酸钠质量分数偏大,故答案为:偏大;偏大。

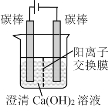
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
【题目】某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式 ________。
②艳艳同学认为不妥,补充实验Ⅲ:
实验编号 | 实验操作 | 实验现象 |
Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
根据实验Ⅲ,可推断白雾成分是______,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
(资料)Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式 _______。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
实验编号 | 实验操作 | 实验现象 |
Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
①实验Ⅴ的目的是 ______。
②通过以上实验,臧臧同学得出的结论是______。