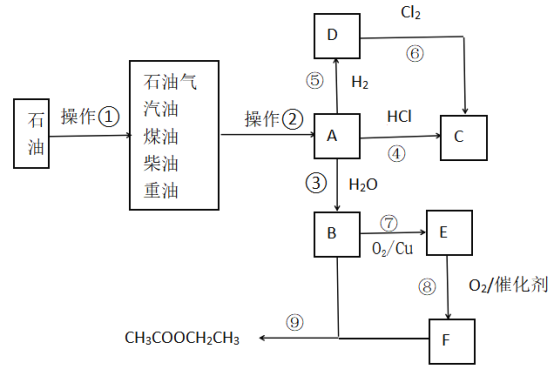
题目内容
【题目】关于如图装置说法正确的是

A. 装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B. 若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C. 若M为FeCl2溶液,可以实现石墨上镀铁
D. 若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
【答案】B
【解析】
试题A.装置中电子移动的途径是:负极到Fe 电极;然后是溶液中的阴离子在阳极石墨放电到电源的正极,错误;B.若 M为NaCl溶液,通电一段时间后,阳极产生H2,溶液中的NaOH与阳极产生的Cl2发生反应产生NaCl和NaClO,所以溶液中可能有NaClO,正确;C.若M为FeCl2溶液,在阳极溶液中的Fe2+失去电子变为Fe3+,所以不可能实现石墨上镀铁,错误;D.若M是海水,该装置是电解池,是外接电源的阴极保护方法使铁不被腐蚀,不是 “牺牲阳极的阴极保护法”,错误。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c