题目内容
【题目】研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。请回答下列问题:
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol1
2NO2(g) ΔH=113.0 kJ·mol1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的△H=___________。
SO3(g)+NO(g)的△H=___________。
(2)在一定条件下氨气可以合成尿素:2NH3(g)+CO2(g)![]() (NH2)2CO(s)+H2O(g)。
(NH2)2CO(s)+H2O(g)。
①一定条件下,在2 L的恒容密闭容器中,充入2 mol NH3和1mol CO2,反应经5 min后达到平衡,测得容器中水蒸气为0.6 mol,则平均反应速率v(CO2)=____________mol/(L·min)。
②尿素的合成过程分两步进行:
2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l)
NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g)
(NH2)2CO(g)+H2O(g)
第一步反应在11.1 Mpa、160 ℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低。因此,总反应的反应速率和转化率主要取决于____________(填“第一步”或“第二步”)。
③将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),不能判断该分解反应已经达到化学平衡状态的是________(填字母)。
2NH3(g)+CO2(g),不能判断该分解反应已经达到化学平衡状态的是________(填字母)。
a.v正(NH3)=2v逆(CO2)
b.密闭容器中氨气的体积分数不变
c.密闭容器中混合气体的平均相对分子质量不变
d.密闭容器中混合气体的密度不变
(3)在一定条件下焦炭可以还原NO2,反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,
N2(g)+2CO2(g),在恒温条件下,
3 mol NO2和足量C发生该反应,测得平衡时NO2和N2的物质的量浓度与平衡总压的关系如图所示:
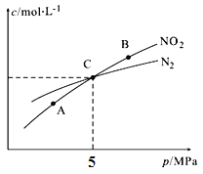
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”“>”或“=”)。
②A、B、C三点中NO2的转化率最小的是 (填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将CH4+2NO2![]() CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2。则电池的正极电极反应式为______________。
CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2。则电池的正极电极反应式为______________。
【答案】
(1)41.8 kJ·mol1(2分)
(2)①0.06(2分) ②第二步(1分) bc(2分)
(3)①=(1分) ②B(2分) ③5MPa(2分)
(4)2NO2+8e![]() 4O2+N2(2分)
4O2+N2(2分)
【解析】
试题分析:
(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2(g)+2SO2(g) ![]() 2SO3(g)+2NO(g) ΔH=83.6 kJ·mol1,则NO2+SO2
2SO3(g)+2NO(g) ΔH=83.6 kJ·mol1,则NO2+SO2![]() SO3+NO ΔH=41.8 kJ·mol1;
SO3+NO ΔH=41.8 kJ·mol1;
(2)①反应经5 min后达到平衡,测得容器中水蒸气的物质的量为0.6 mol,则根据方程式可知消耗的CO2是0.6 mol,所以平均反应速率v(CO2)=![]() =0.06 mol/(L·min)。
=0.06 mol/(L·min)。
②总反应的反应速率和转化率主要取决于反应速率慢的,即取决于第二步。
③a.v正(NH3)=2v逆(CO2)方向不一致,且满足反应速率之比等于相应的化学计量数之比,能说明反应达到平衡状态,a正确;b.根据方程式可知氨气与二氧化碳的体积之比始终为2∶1,不会随反应方向变化而变化,与平衡无关,不能判断该分解反应已经达到化学平衡,b错误;c.密闭容器中混合气体只有NH3和CO2且二者的物质的量之比恒定,因此混合气体的平均相对分子质量始终不变,c错误;d.当体系达平衡状态时,混合气体的总质量不变,而容器的体积不变,密闭容器中混合气体的密度不变,说明达平衡状态,d正确,答案选bc。
(3)①平衡常数只与温度有关系,则A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)。
②正反应体积增大,增大压强平衡向逆反应方向移动,反应物转化率减小,则A、B、C三点中NO2的转化率最小的是B点。
③ 2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 3 0 0
转化量(mol) 2x x 2x
平衡量(mol) 32x x 2x
C点氮气和NO2浓度相等,因此32x=x,解得x=1,所以NO2、N2、CO2的物质的量之比是1∶1∶2,则C点时该反应的压强平衡常数Kp(C)=![]() =5 MPa。
=5 MPa。
(4)原电池正极得到电子,根据方程式可知正极是NO2得电子,电极反应式为2NO2+8e![]() 4O2+N2。
4O2+N2。