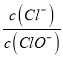题目内容
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:______________________。
(2)As2O3在上述反应中________。
A.被氧化 B.被还原
C.既被氧化又被还原 D.既未被氧化又未被还原
(3)该反应的氧化产物是________,氧化剂是________。
(4)若生成0.1 mol AsH3,则转移的电子数为________。(用NA表示)
【答案】 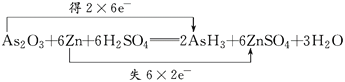 B ZnSO4 As2O3 0.6NA
B ZnSO4 As2O3 0.6NA
【解析】(1)反应中,每个Zn原子失去2个电子,2个As原子得到12个电子,根据电子守恒,转移电子是12,则双线桥法标出电子转移的方向和数目为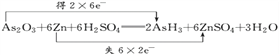
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,As元素的化合价降低,则As2O3为氧化剂,表现氧化性,被还原,故选B。(3)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中中,As元素的化合价降低,则As2O3为氧化剂,被还原,Zn是还原剂,被氧化,氧化产物为ZnSO4;(4)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中生成2molAsH3转移12mol电子,则生成0.1molAsH3,则转移的电子数为0.6mol电子,即转移的电子数为0.6NA。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目