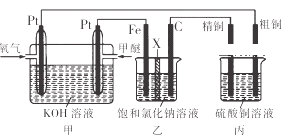
题目内容
【题目】下列实验装置不能达到实验目的是
A.  配置稀硫酸溶液 B.
配置稀硫酸溶液 B. 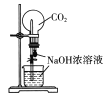 用CO2做喷泉实验
用CO2做喷泉实验
C. 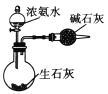 制取干燥纯净的氨气 D.
制取干燥纯净的氨气 D.  比较碳酸钠和碳酸氢钠稳定性
比较碳酸钠和碳酸氢钠稳定性
【答案】A
【解析】
A.容量瓶只能用来配制一定体积的溶液,不能用来溶解和稀释溶液,故A错误;B.CO2可以与NaOH发生反应:2NaOH+CO2=Na2CO3+H2O,可以用来做喷泉实验,故B正确;C.生石灰可以和浓氨水中的水结合,同时反应放热,有氨气生成,氨气是碱性气体能用碱石灰来干燥,可以制得干燥纯净的氨气,故C正确;D.碳酸氢钠不稳定,小试管中温度低,则大试管中装碳酸钠固体,小试管中装碳酸氢钠固体,小试管通入的澄清石灰水变浑浊,装置可以用于比较它们的稳定性,故D正确,本题选A。

 阅读快车系列答案
阅读快车系列答案【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。
【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A. 25℃时,CuS的溶解度大于MnS的溶解度
B. 25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C. 因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂