��Ŀ����
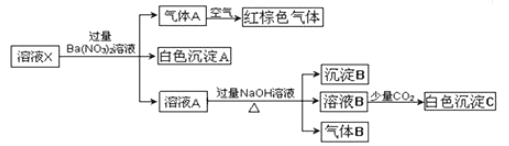
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ�������й�˵����ȷ���ǣ�������
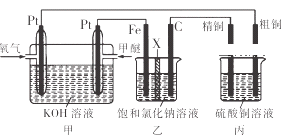
A. ��Ӧһ��ʱ�����װ�������ɵ�����������������
B. ��װ�������缫Ϊ�������缫��ӦʽΪFe��2e ��=Fe2+
C. ͨ��������һ��Ϊ�����������ĵ缫��ӦΪO2��4e ��+2H2O�T4OH��
D. ��Ӧһ��ʱ���װ��������ͭ��ҺŨ�ȱ��ֲ���
���𰸡�A
��������
�����װ��Ϊ����ȼ�ϵ�أ�Ͷ��������һ��������ԭ��Ӧ��Ϊ�缫��������Ͷ��ȼ�ϵ�Ϊ�缫�ĸ�������װ��Ϊ��ⱥ���Ȼ��Ƶ�װ�ã����ݴ�������У����ӵ�ת�ƣ���֪Fe�缫Ϊ������C��Ϊ��������װ��Ϊ��⾫��ͭ��װ�ã���ͭΪ��������ͭΪ������A����װ����������Ӧ2H++2e-��H2�������Է�Ӧһ��ʱ���װ�������ɵ�������������������A��ȷ��B����װ����������ӦΪ2H++2e-��H2���� B����C��Ͷ��������һ��������ԭ��Ӧ��Ϊ�缫�������������ĵ缫��ӦΪ��O2+2H2O+4e-��4OH-��C����D����װ���У���ͭ������ͭ����������Ӧ�⣬�����ͭǰ��Ľ���ҲҪ��Ӧ�������ھ�ͭ������ͭ���ӱ���ԭ�⣬û�����������ܱ���ԭ�����ݵ�ʧ������ȣ���֪����ͭ��ҺŨ�ȼ�С��D����ѡA��