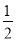题目内容
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
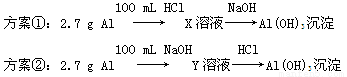
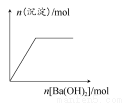
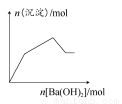
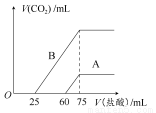
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
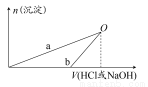
A.b曲线表示的是向X溶液中加入NaOH溶液
B.在O点时两方案中所得溶液浓度相等
C.a、b曲线表示的反应都是非氧化还原反应
D.X溶液显酸性,Y溶液呈碱性
A
【解析】选A。n(Al)=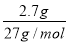 =0.1 mol,100 mL盐酸中n(H+)=0.1 L×3 mol/L=0.3 mol,100 mL NaOH溶液中n(OH-)=0.1 L×3 mol/L=0.3 mol。
=0.1 mol,100 mL盐酸中n(H+)=0.1 L×3 mol/L=0.3 mol,100 mL NaOH溶液中n(OH-)=0.1 L×3 mol/L=0.3 mol。
由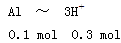 知方案①中X为AlCl3,向其中加入NaOH立即生成沉淀,图像为曲线a,由
知方案①中X为AlCl3,向其中加入NaOH立即生成沉淀,图像为曲线a,由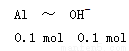 知方案②中Y为NaOH和NaAlO2的混合物,向其中加入HCl,先发生H++OH-=H2O,开始无现象,后来产生沉淀,图像为曲线b,A项错误。O点时Al3+完全沉淀,溶质只有NaCl,由于开始时n(HCl)=n(NaOH)。n(NaCl)相同,B项正确。a、b曲线反应都是复分解反应,C项正确。AlCl3溶液中由于Al3+水解,溶液显酸性,D项正确。
知方案②中Y为NaOH和NaAlO2的混合物,向其中加入HCl,先发生H++OH-=H2O,开始无现象,后来产生沉淀,图像为曲线b,A项错误。O点时Al3+完全沉淀,溶质只有NaCl,由于开始时n(HCl)=n(NaOH)。n(NaCl)相同,B项正确。a、b曲线反应都是复分解反应,C项正确。AlCl3溶液中由于Al3+水解,溶液显酸性,D项正确。

练习册系列答案
相关题目