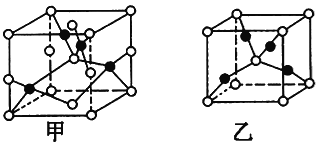
题目内容
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)仪器a的名称是___________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_______。
②同时c中有气体产生,该气体的作用是______。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是_______;
(4)指出装置d可能存在的缺点________。
【答案】分液(或滴液)漏斗 Zn+2Cr3+===Zn2++2Cr2+ 排除c中空气 c中产生H2使压强大于大气压 敞开体系,可能使醋酸亚铬与空气接触
【解析】
醋酸亚铬在气体分析中用作氧气吸收剂,说明亚铬离子具有强还原性,易与氧气反应,则制备实验中应避免接触氧气,实验时,将过量锌粒和氯化络固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3,盐酸与锌反应可生成氢气,可将装置内的空气排出,避免亚铬离子被氧化,且发生Zn+2Cr3+=Zn2++2Cr2+,可观察到c中溶液由绿色逐渐变为亮蓝色,打开K3,关闭K1和K2,c中压强增大,可将亮蓝色溶液流入d,可生成醋酸亚铬砖红色沉淀,以此解答该题。
(1)由装置图可知a为分液漏斗或滴液漏斗;
(2)①c中溶液由绿色逐渐变为亮蓝色,说明生成亚铬离子,反应的离子方程式为Zn+2Cr3+=Zn2++2Cr2+;
②盐酸与锌反应可生成氢气,可将装置内的空气排出,避免亚铬离子被氧化;
(3)打开K3,关闭K1和K2,c中产生H2使压强大于大气压,可使亮蓝色溶液流入d;
(4)d为敞开体系,可能使醋酸亚铬与空气接触而被氧化,应在密闭容器中制备,且缺少氢气的处理装置。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】化学反应条件是研究化学反应的重要方向。
(1)化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g)+H2(g) △H=+139kJ·mol-1
C4H8(g)+H2(g) △H=+139kJ·mol-1
一定条件下,以异丁烷为原料生产异丁烯,在202kPa和808kPa下异丁烷平衡转化率随温度的变化如图所示。
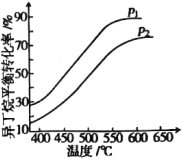
①p1=_______kPa,选择异丁烯制备的温度条件是550~600℃的理由是_________________。
②若平衡混合气中异丁烯的体积分数为25%,则异丁烷的平衡转化率为_______%(保留小数点后1位)。
(2)异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-0为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以r-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26. 17 | 27. 11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a 载体会影响催化剂的活性 b 载体会影响催化剂的选择性 c 载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:__________。
(3)工业上用复合氧化钴(组成为Co3O4)、碳酸锂以Li/Co(原子比)=1混合,在空气中900℃下加热5小时制备锂离子电池正极材料LiCo O2,写出制备LiCoO2的化学方程式__________。废旧的锂离子电池需要回收,“放电处理”废旧的锂离子电池有利于锂在正极回收的原因是____________。