题目内容
 (1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3
Al2O3
,Al2(SO4)3溶液蒸干最后得到的固体产物是Al2(SO4)3
Al2(SO4)3
;(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
.(3)写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:
2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO
2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO
.(4)已知[Ksp(AgBr)]=5.4×10-13,[Ksp(AgCl)]=2.0×10-10.向浓度均为0.1mol?L-1的KBr、NaCl混合溶液中滴入0.1mol?L-1的AgNO3溶液,首先生成的沉淀是
AgBr
AgBr
.当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=2.7×10-3
2.7×10-3
.(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
分析:(1)AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3;Al2(SO4)3溶液中水解生成氢氧化铝和硫酸,加热蒸发,硫酸是难挥发性酸,蒸出的为水,得到硫酸铝固体;
(2)用NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,可做泡沫灭火剂;
(3)可以看成Cl2+H2O═H++Cl-+HClO,加入Na2CO3后会与H+ 反应,溶液中H+ 多,所以碳酸钠和氢离子全部反应生成二氧化碳;
(4)溶度积越小,越易生成沉淀,当容器中同时出现AgCl和AgBr沉淀,可根据溶度积计算;
(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,反应过程是二氧化碳和氢氧根离子反应生成碳酸根离子,碳酸根离子和钙离子反应生成碳酸钙沉淀,钙离子沉淀完,二氧化碳继续和氢氧根离子反应生成碳酸根离子,氢氧根离子全部反应后,二氧化碳和碳酸根离子反应生成碳酸氢根离子,继续通入二氧化碳和碳酸钙沉淀反应生成碳酸氢钙,沉淀溶解,依据反应的定量关系画出图象;
(2)用NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,可做泡沫灭火剂;
(3)可以看成Cl2+H2O═H++Cl-+HClO,加入Na2CO3后会与H+ 反应,溶液中H+ 多,所以碳酸钠和氢离子全部反应生成二氧化碳;
(4)溶度积越小,越易生成沉淀,当容器中同时出现AgCl和AgBr沉淀,可根据溶度积计算;
(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,反应过程是二氧化碳和氢氧根离子反应生成碳酸根离子,碳酸根离子和钙离子反应生成碳酸钙沉淀,钙离子沉淀完,二氧化碳继续和氢氧根离子反应生成碳酸根离子,氢氧根离子全部反应后,二氧化碳和碳酸根离子反应生成碳酸氢根离子,继续通入二氧化碳和碳酸钙沉淀反应生成碳酸氢钙,沉淀溶解,依据反应的定量关系画出图象;
解答:解:(1)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;Al2(SO4)3溶液中水解生成氢氧化铝和硫酸,加热蒸发,硫酸是难挥发性酸,蒸出的为水,得到硫酸铝固体;
故答案为:Al2O3; Al2(SO4)3;
(2)用NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,反应的离子方程式为3HCO3-+Al3+═Al(OH)3↓+3CO2↑,
故答案为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
(3)可以看成Cl2+H2O═H++Cl-+HClO,加入Na2CO3后会与H+ 反应,溶液中H+ 多,所以碳酸钠和氢离子全部反应生成二氧化碳,反应的离子方程式为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO;
故答案为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO;
(4)溶度积越小,越易生成沉淀,则首先生成AgBr,
当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=
=
=2.7×10-3;
故答案为:AgBr;2.7×10-3;
(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中含氢氧根离子为0.3mol,不断通入CO2至过量,CO2+2OH-═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO2+2OH-═CO32-+H2O,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2,生成碳酸钙最大量为0.1mol,消耗氢氧根离子0.2mol,消耗二氧化碳气体0.1mol,标准状况体积为2.24L,剩余氢氧根离子为0.1mol,生成碳酸根离子物质的量为0.05mol,消耗二氧化碳0.05mol,继续通入二氧化碳和碳酸根离子反应生成碳酸氢根离子,消耗二氧化碳0.05mol,沉淀不变消耗二氧化碳0.1mol,标准状况体积为2.24L,再继续通入二氧化碳溶解碳酸钙沉淀需要二氧化碳0.1mol,标准状况体积为2.24L,依据计算得到的数据绘制图形得到: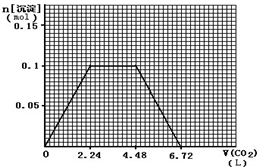 ;
;
故答案为:
故答案为:Al2O3; Al2(SO4)3;
(2)用NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,反应的离子方程式为3HCO3-+Al3+═Al(OH)3↓+3CO2↑,
故答案为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
(3)可以看成Cl2+H2O═H++Cl-+HClO,加入Na2CO3后会与H+ 反应,溶液中H+ 多,所以碳酸钠和氢离子全部反应生成二氧化碳,反应的离子方程式为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO;
故答案为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO;
(4)溶度积越小,越易生成沉淀,则首先生成AgBr,
当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=
| Ksp(AgBr) |
| Ksp(AgCl) |
| 5.4×10-13 |
| 2×10-10 |
故答案为:AgBr;2.7×10-3;
(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中含氢氧根离子为0.3mol,不断通入CO2至过量,CO2+2OH-═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO2+2OH-═CO32-+H2O,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2,生成碳酸钙最大量为0.1mol,消耗氢氧根离子0.2mol,消耗二氧化碳气体0.1mol,标准状况体积为2.24L,剩余氢氧根离子为0.1mol,生成碳酸根离子物质的量为0.05mol,消耗二氧化碳0.05mol,继续通入二氧化碳和碳酸根离子反应生成碳酸氢根离子,消耗二氧化碳0.05mol,沉淀不变消耗二氧化碳0.1mol,标准状况体积为2.24L,再继续通入二氧化碳溶解碳酸钙沉淀需要二氧化碳0.1mol,标准状况体积为2.24L,依据计算得到的数据绘制图形得到:
 ;
;故答案为:

点评:本题考查了盐类水解的应用,溶液酸碱性分析判断,化学方程式的书写产物判断,溶度积常数的计算理解,计算反应过程中物质的量的变化图象绘制能力,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 ?Al(OH)3+3H+
?Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+ HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O  H2S+OH-
H2S+OH-