题目内容
【题目】氨气遇HCl气体时,有白烟出现,其反应为NH3+HCl===NH4Cl,该反应的反应类型是( )
A. 分解反应 B. 置换反应
C. 化合反应 D. 复分解反应
【答案】C
【解析】根据反应的特点,此反应属于化合反应,故选项C正确。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
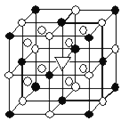
金状元绩优好卷系列答案【题目】(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,是图中●、○中的一种。图中●、○分别指代哪种粒子_____________;
(2)H2S和H2O2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2S | 187 | 202 | 2.6 |
H2O2 | 272 | 423 | 以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因________________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有____________________(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有___________________。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4H2O晶体。实验中所加C2H5OH的作用是____________________________。
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与![]() 分子互为等电子体的微粒(填1种)__________________。
分子互为等电子体的微粒(填1种)__________________。
(2)水分子在特定条件下容易得到一个![]() ,形成水合氢离子(
,形成水合氢离子(![]() )。下列对上述过程的描述不合理的是__________________。
)。下列对上述过程的描述不合理的是__________________。
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(3)![]() 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有(填元素符号)。
(5)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有___________________。
(6)实验过程中加入![]() 后可观察到析出深蓝色
后可观察到析出深蓝色![]() 晶体。实验中所加
晶体。实验中所加![]() 的作用是__________________________________________________
的作用是__________________________________________________

