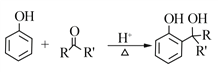
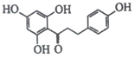
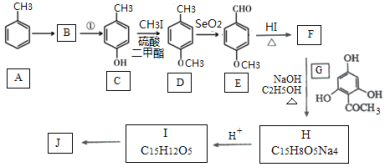
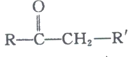题目内容
【题目】恒温、恒容:N2 (g) + 3H2(g)![]() 2NH3(g);△H=-QkJ·mol-1。向甲、乙两个容积相同的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
2NH3(g);△H=-QkJ·mol-1。向甲、乙两个容积相同的密闭容器中分别充入1molN2、3molH2和2molNH3、1molAr,平衡时有关数据如下:
容 器 | 甲 | 乙 |
平衡时NH3的体积分数 | ω1 | ω2 |
平衡时N2的浓度(mol·L-1) | c1 | c2 |
反应的能量变化(kJ) | Q1 | Q2 |
反应物的转化率 | α1 | α2 |
下列说法不正确的是
A.ω1=ω2B.c1 =c2C.Q1+Q2 =QD.α1+α2 = 1
【答案】A
【解析】
2mol氨气如果完全转化为氮气和氢气,分别是1mol和3mol。由于是保持温度和容积不变,所以甲乙两容器中的平衡状态是等效的。体积不变,充入1molAr平衡不移动,所以平衡时氮气的浓度、反应物的转化率以及反应的能量变化均是相同的。但由于充入了Ar,导致气体的总的物质的量增加,氨气的物质的量不变,所以氨气的体积分数减小,所以选项BCD均是正确的,答案选A。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目